ЛЕЧЕНИЕ САРКОМЫ ЮИНГА
Саркома Юинга является второй по распространенности первичной злокачественной опухолью костей, поражающей в основном подростков во втором десятилетии жизни, и является высокометастатическим классом сарком. Несмотря на использование радиотерапии или хирургии, по оценкам, 85–90 % пациентов в прошлом умирали в течение нескольких месяцев после метастазирования. Но сегодня, благодаря значительному прогрессу в лечении заболевания как местной терапией, так и многокомпонентной адъювантной химиотерапией, 5-летняя выживаемость увеличилась с менее чем 20 % до более чем 70 %. Однако частота рецидивов по-прежнему остается высокой. Ее необходимо распознавать и лечить быстро, чтобы предотвратить высокую заболеваемость и смертность. Саркома Юинга (СЮ) является агрессивной опухолью, встречающейся у подростков и молодых людей, на долю которой приходится 10–15 % всех сарком костей.
Впервые он был описан Джеймсом Юингом в 1921 году. Семейство саркомы Юинга включает «классическую» костную саркому Юинга, внескелетную саркому Юинга, злокачественную мелкоклеточную опухоль грудной стенки (опухоль Аскина) и примитивные нейроэктодермальные опухоли мягких тканей (PNET). Транслокация t(11;22)(q24;q12) связана с 85% опухолей и приводит к образованию EWS-FLI-1, тогда как t(21;12)(22;12) и другие менее распространенные транслокации вызывают EWS-FLI Induces -1. Слияние ERG составляет оставшиеся 10%-15% случаев. Наиболее распространенные анатомические области включают таз, осевой скелет и бедренную кость; однако это может произойти практически в любой кости или мягкой ткани. Обычно пациенты жалуются на боль и отек в области поражения. Хотя большинство из них локально присутствуют, почти все имеют субклиническую метастатическую болезнь. Примерно у 25% пациентов с первоначальной локализованной болезнью в конечном итоге наступает рецидив.
Стандартного лечения рецидивирующего и рефрактерного ЭС не существует. Не существует связи между ЭС и факторами риска окружающей среды, воздействием лекарственных препаратов, историей радиации или семейным анамнезом рака. Саркома Юинга состоит из небольших круглых клеток с повышенным ядерно-цитоплазматическим соотношением, представляющих семейство небольших круглых синеклеточных опухолей детского возраста (например, ретинобластома, нейробластома, рабдомиосаркома и нефробластома). Клетки Юинга имеют скудную эозинофильную цитоплазму, содержащую обильный гликоген, и это обычно обнаруживается с помощью окрашивания периодической кислотой Шиффа. Высокая экспрессия CD99 была продемонстрирована более чем в 80% случаев. Этот высокочувствительный иммуногистохимический биомаркер, вероятно, играет ключевую роль в обеспечении устойчивой миграции лейкоцитов в эндотелий; однако он не обладает специфичностью, поскольку его также можно обнаружить при других саркомах и лимфомах. Помимо продукта гена MIC2 CD99, клетки Юинга часто экспрессируют CD45, синаптофизин, хромогранин, виментин, виментин, кератин, десмин, нейрон-специфическую енолазу (NSE) и S-100. Однако эта иммуногистохимическая панель ограничена отсутствием специфичности. Для проведения окончательного различия необходимы молекулярно-генетические исследования с использованием флуоресцентной гибридизации in situ (FISH) и/или полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР).
Результаты исследования саркомы Юинга: У пациентов с саркомой Юинга обычно наблюдаются местные симптомы, такие как боль, скованность или отек в течение нескольких недель или месяцев. Более 50% пациентов с ES испытывают перемежающуюся боль, которая усиливается ночью. Саркома Юинга может возникать в самых разных местах и иметь различные проявления. Обычно она обнаруживается в диафизах длинных трубчатых костей. Костные поражения или метастатические поражения в длинных костях могут проявляться в виде патологических переломов. Тазовое расположение ES может проявляться болью в спине. Наличие системных симптомов, таких как лихорадка и потеря веса, часто указывает на метастатическое заболевание. Примерно у 20% пациентов на момент постановки диагноза обнаруживается метастатическое заболевание, и более чем в 20% этих случаев наблюдается поражение легких или плевры.
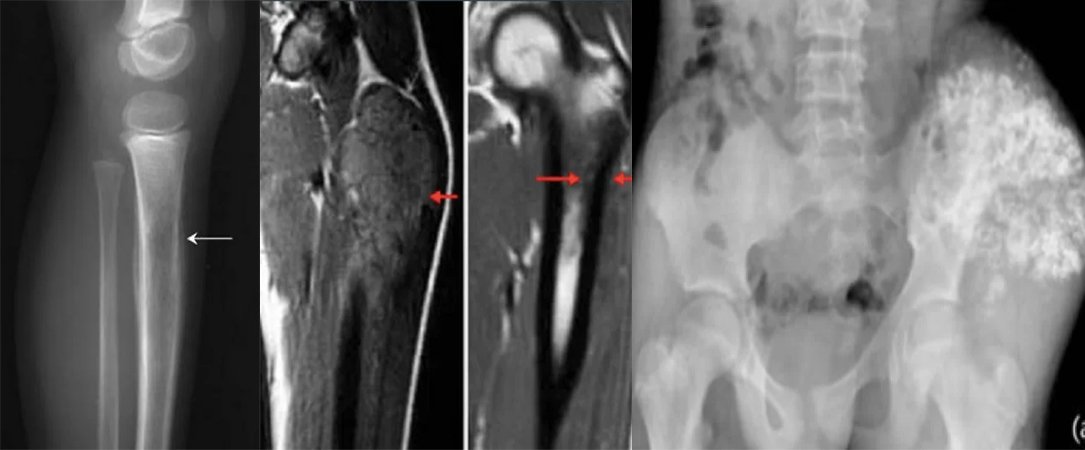
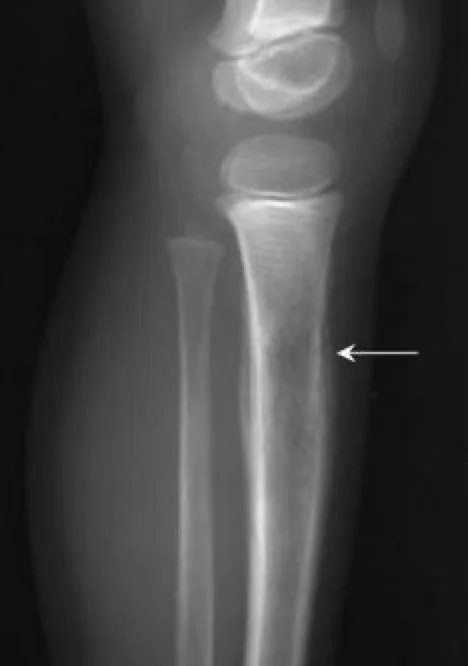
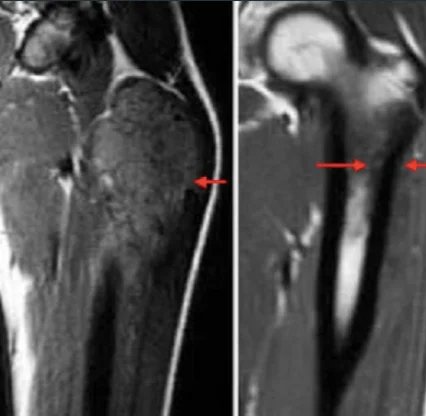
Важно провести комплексное физическое обследование. В случае метастазов в легкие и плевру у пациента могут быть асимметричные звуки дыхания, плевральные симптомы или хрипы. У пациентов с метастазами в костный мозг могут возникнуть петехии или пурпура из-за тромбоцитопении. Неврологическое обследование также важно для пациентов с поражением ЦНС. Первичные обследования включают рентгенографию пораженной области; на рентгеновском снимке может быть виден «луковичный» вид периостальной реакции. Первичный участок и потенциальные метастатические области следует оценивать с помощью визуализирующих тестов. Простые рентгенограммы пораженной области могут показать «изъеденные молью» поражения, которые разрушают кость, «треугольник Кодмана» или многослойную «луковичную» периостальную реакцию. Согласно обновленному руководству Национальной комплексной онкологической сети (NCCN) 2017 года, визуализация первичных областей выполняется с помощью МРТ и, при необходимости, КТ, причем МРТ с введением контрастного вещества имеет первостепенное значение. Другие методы визуализации включают КТ грудной клетки, позитронно-эмиссионную томографию (ПЭТ)/КТ и МРТ позвоночника/таза. Пациента с симптомами следует направить к ортопеду-онкологу, если требуется биопсия. Диагноз предпочтительно ставить с помощью игольчатой биопсии или открытой биопсии. Молекулярно-цитогенетическое исследование образцов биопсии следует включить в диагностическое обследование для оценки транслокации T(11;22). Можно рассмотреть аспирацию костного мозга и биопсию костного мозга. Согласно рекомендациям NCCN, первоначальная оценка должна включать сывороточную лактатдегидрогеназу (ЛДГ), поскольку она имеет прогностическое значение. Пациентам также следует предложить консультацию по вопросам фертильности (заморозка сперматозоидов) перед началом лечения.
Химиотерапия и радиотерапия саркомы Юинга: Исторически межгрупповые исследования саркомы Юинга (IESS-I и IESS-II) сравнивали RT+VACA (винкристин, дактиномицин и циклофосфамид) с VAC (винкристин, дактиномицин и циклофосфамид). лучшие результаты были показаны с циклофосфамидом и доксорубицином. Из-за ограничения дозы доксорубицина в схемах с дактиномицином последующие исследования не показали значительного влияния на клинические исходы при исключении дактиномицина. Несколько исследований оценивали добавление ифосфамида и этопозида к стандартной химиотерапии. Исследование Pediatric Oncology Group-Child Cancer Group INT0091 показало, что в группе VACD-IE показатели выживаемости были значительно выше, чем в группе VACD.
Кроме того, частота локальной неудачи была ниже в группе VACD-IE. В исследовании EICESS-92 (European Intergroup Cooperative Ewing Sarcoma Study) VACA (винкристин, дактиномицин, циклофосфамид и доксорубицин) и VAIA (винкристин, дактиномицин, ифосфамид и доксорубицин) сравнивались у пациентов со стандартным риском (SR), и было обнаружено, что эффект циклофосфамида аналогичен ифосфамиду; однако циклофосфамид был связан с повышенной токсичностью. Показатели 3-летней выживаемости без событий (EFS) составили 73% и 74% для VACA и VAIA соответственно. Исследование Euro-EWING99-R1 (исследование эквивалентности на основе протокола EICESS-92) оценило, может ли циклофосфамид заменить ифосфамид в консолидационной терапии, включая винкристин и дактиномицин у пациентов со стандартным риском, и сравнило VAC (винкристин, дактиномицин и циклофосфамид) с VAI (винкристин, дактиномицин и циклофосфамид). ифосфамид) предположил, что он статистически не уступает; однако VAI был связан с немного более высокой 3-летней выживаемостью без событий EFS. В исследовании фазы III (AEWS0031) от Детской онкологической группы (COG) пациенты получали VDC попеременно с IE каждые три недели. Исследование показало, что 2-недельные интервалы были более эффективными, чем 3-недельные интервалы без увеличения токсичности.
Эти результаты привели к тому, что VDC/IE стал стандартом лечения в Соединенных Штатах. Химиотерапию начинают до местного лечения и продолжают после операции, если нет признаков прогрессирования. Хирургическая резекция и лучевая терапия являются местными контрольными методами лечения. На сегодняшний день нет исследований, сравнивающих эффективность этих двух подходов. Исследование INT-0091 не обнаружило существенных различий в локальной неудаче или выживаемости без событий между только хирургическим вмешательством и только лучевой терапией. Однако было обнаружено, что хирургическое вмешательство плюс лучевая терапия связано с более низкой частотой локальной неудачи. Несмотря на это, мы считаем, что рецидив заболевания неизбежен в случаях, когда применяется только лучевая терапия без хирургического лечения. Данные 1058 пациентов из исследований CESS 81, CESS 86 и EICES-92 показали, что хирургическое вмешательство + лучевая терапия и только хирургическое вмешательство имели значительно более низкую частоту локальной неудачи, чем только лучевая терапия. Частота локальной неудачи была схожей в предоперационной группе лучевой терапии и в хирургической группе с послеоперационной лучевой терапией или без нее. На основании данных, полученных от пациентов, включенных в исследования INT-0091, INT-0154 или AEWS0031, было показано, что хирургическое вмешательство + лучевая терапия были связаны с более низким риском локальной неудачи по сравнению с лучевой терапией в отдельности.
2. Хондросаркома
Лечение хондросаркомы: Симптомы хондросаркомы:
Что такое хондросаркома?
Хондросаркома — это тип рака костей, который развивается из хрящевых клеток. Хрящ — это специализированная соединительная ткань, встречающаяся у взрослых, и из нее развивается большинство костей. Хрящ играет важную роль в процессе роста. В организме существует множество различных типов хрящей. Хондросаркома в первую очередь поражает хрящевые клетки в бедренной кости (бедренной кости), руке, тазу или колене. Другие области (например, ребра) также могут быть затронуты, хотя и реже. Хондросаркома — второй по распространенности тип первичного рака костей. Первичный рак костей — это рак, который начинается в кости. Этот тип рака редко поражает людей моложе 20 лет. Риск продолжает расти до 75 лет. Заболеваемость одинакова среди мужчин и женщин.
Что вызывает хондросаркому?
Точная причина хондросаркомы неизвестна. Может быть генетический или хромосомный компонент, который делает некоторых людей более восприимчивыми к таким злокачественным новообразованиям. Хондросаркомы наблюдались как позднее последствие лучевой терапии других видов рака.
Каковы факторы риска хондросаркомы?
Чаще всего хондросаркома возникает из нормальных хрящевых клеток. Она также может возникнуть из-за уже существующей доброкачественной (нераковой) опухоли кости или хряща. Ниже приведен список некоторых доброкачественных состояний, которые могут присутствовать при возникновении хондросаркомы:
- Энхондромы. Тип доброкачественной опухоли кости, которая начинается в хряще и обычно поражает руки (она также может поражать другие области).
- Множественные экзостозы (остеохондромы). Наличие множественных остеохондром.
- Болезнь Олье. Группа энхондром (доброкачественных опухолей хряща, которые обычно поражают руки).
- Синдром Маффуччи. Сочетание множественных энхондром (доброкачественных опухолей хряща, которые обычно поражают руки) и ангиом (доброкачественных опухолей, состоящих из кровеносных сосудов).
Каковы симптомы хондросаркомы?
Симптомы хондросаркомы могут различаться в зависимости от расположения опухоли. Ниже приведены наиболее распространенные симптомы хондросаркомы. Однако симптомы могут проявляться по-разному у каждого человека. Симптомы могут включать:
- Большая масса в пораженной кости
- Ощущение давления вокруг массы
- Боль, которая постепенно усиливается с течением времени. Обычно усиливается ночью и может быть облегчена приемом противовоспалительных препаратов, таких как ибупрофен. Обычно не облегчается отдыхом.
- Локальный отек
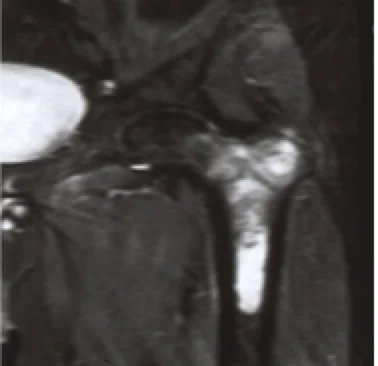
Как диагностируется хондросаркома?
Помимо полного анамнеза и физического обследования, диагностические процедуры для хондросаркомы могут включать следующее:
- Рентген. Это диагностический тест, который использует невидимые лучи электромагнитной энергии для преобразования изображений внутренних тканей, костей и органов в пленку.
- Компьютерная томография (также называемая КТ или КТ-сканированием). Это визуальный тест, который использует рентгеновские лучи и компьютер для создания подробных изображений тела. КТ-сканирование показывает детали костей, мышц, жира и органов.
- Магнитно-резонансная томография (МРТ). Диагностическая процедура, которая использует комбинацию больших магнитов, радиочастот и компьютеров для получения подробных изображений органов и структур в организме.
- Позитронно-эмиссионная томография (ПЭТ). Визуальный тест, при котором радиоактивно меченая глюкоза (сахар) вводится в кровоток. Ткани, которые используют глюкозу больше, чем нормальные ткани (например, опухоли), могут быть обнаружены сканирующим аппаратом.
- Биопсия. Процедура, при которой образцы ткани извлекаются из организма (либо путем инъекции, либо во время операции) для исследования под микроскопом. Это делается для определения наличия раковых или других аномальных клеток.
Лечение хондросаркомы:
Конкретное лечение хондросаркомы будет определяться вашим лечащим врачом на основе:
- Вашего возраста, общего состояния здоровья и истории болезни
- Типа, стадии (распространения) и местоположения рака
- Вашей переносимости определенных лекарств, процедур и методов лечения
- Ожиданий относительно течения заболевания
- Вашего мнения или предпочтений
Целью лечения хондросаркомы является удаление массы и снижение вероятности ее повторного появления. Лечение может включать:
- Хирургическое вмешательство. Удаление опухоли. Если опухоль находится в руке или ноге, хирург попытается спасти конечность. В некоторых случаях может потребоваться ампутация.
- Физиотерапия. Это лечение помогает восстановить силу и использование пораженной области после операции.
- Лучевая терапия. Радиация может назначаться в высоких дозах.
- Химиотерапия. Хотя это не первичное лечение, она может потребоваться, если рак распространился на другие части тела.
3. Остеосаркома
Что такое остеосаркома?
Остеосаркома (ОС) или остеогенная саркома (ОГС) (или рак кости для краткости) — это раковая опухоль в кости. В частности, это агрессивное злокачественное новообразование, возникающее из примитивных трансформированных клеток мезенхимального происхождения, проявляющее остеобластическую дифференцировку и продуцирующее злокачественный остеоид. Остеосаркома — наиболее распространенная гистологическая форма первичной саркомы кости. Чаще всего встречается у подростков и молодых людей.
Симптомы остеосаркомы:
Многие пациенты сначала жалуются на длительную боль, которая усиливается ночью, может быть прерывистой и иметь разную интенсивность. Молодые люди, активно занимающиеся спортом, часто жалуются на боль в нижней части бедренной кости или чуть ниже колена. Если опухоль большая, она может проявляться в виде заметной локализованной припухлости. Иногда первым симптомом может быть внезапный перелом, поскольку пораженная кость не так прочна, как нормальная кость, и может ненормально сломаться при незначительной травме. В более глубоких опухолях, которые не очень близко расположены к коже, например, исходящих из таза, локализованный отек может быть неочевидным.
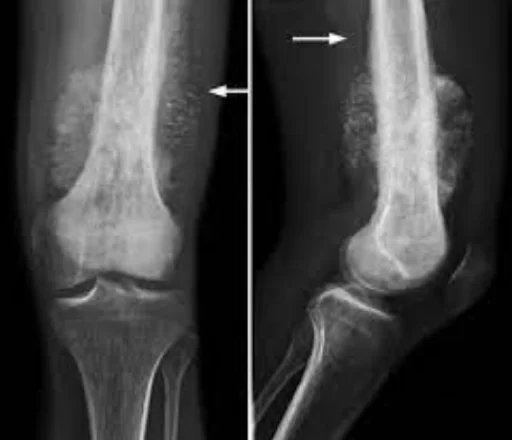
Причины остеосаркомы:
Семейные случаи, в которых делеция хромосомы 13q14 инактивирует ген ретинобластомы, связаны с высоким риском развития остеосаркомы. Костные дисплазии, включая болезнь Педжета костей, фиброзную дисплазию, энхондроматоз и наследственные множественные экзостозы, увеличивают риск остеосаркомы.
Синдром Ли-Фраумени (мутация гена TP53 зародышевой линии) является предрасполагающим фактором для развития остеосаркомы. Синдром Ротмунда-Томсона (т. е. аутосомно-рецессивная ассоциация врожденных дефектов костей, дисплазий волос и кожи, гипогонадизма и катаракты) связан с повышенным риском этого заболевания. Высокие дозы Sr-90 увеличивают риск рака костей и лейкемии у животных и, как предполагается, оказывают то же самое действие на людей.
Вызывает ли фторид остеосаркому?
Не существует четкой связи между фторированием воды и раком или смертями, связанными с раком, как для рака в целом, так и для рака костей и остеосаркомы в частности. Ряд исследований пришли к выводу, что концентрация фторида в воде не связана с остеосаркомой. Убеждения относительно связи между воздействием фторида и остеосаркомой исходят из исследования 1990 года Национальной токсикологической программы США, которое показало неоднозначные доказательства связи между фторидом и остеосаркомой у самцов крыс. Однако до сих пор нет убедительных доказательств того, что фторид имеет тенденцию вызывать рак у мышей. Фторирование воды практикуется во всем мире для улучшения здоровья зубов граждан. Это также считается большим достижением в области здравоохранения. Уровни концентрации фторида в водоснабжении регулируются, например, Агентство по охране окружающей среды США регулирует уровни фторида не более 4 миллиграммов на литр. Фактически, природный фторид уже присутствует в водоснабжении, но многие сообщества решили добавлять больше фторида до такой степени, что он может уменьшить кариес зубов. Фтор также известен своей способностью вызывать образование новой кости. Однако дальнейшие исследования показывают, что фторированная вода не представляет риска остеосаркомы у людей. Большинство исследований включали подсчет числа пациентов с остеосаркомой в определенных областях с различной концентрацией фторида в питьевой воде. Статистический анализ данных показывает, что нет существенной разницы в частоте случаев остеосаркомы в различных фторированных регионах. Другое важное исследование включало сбор образцов костей у пациентов с остеосаркомой для измерения концентрации фторида и сравнения их с образцами костей недавно диагностированных злокачественных опухолей костей. Вывод заключается в том, что средние концентрации фторида в образцах костей пациентов с остеосаркомой и контрольных опухолей существенно не отличались. Было доказано, что не только концентрация фторида в костях, но и воздействие фторида на пациентов с остеосаркомой существенно не отличается от здоровых людей.
Остеосаркома имеет тенденцию возникать в областях роста костей; Вероятно, это происходит потому, что пролиферация предрасполагает остеобластические клетки в этой области к приобретению мутаций, которые могут привести к трансформации клеток (ген RB и ген p53). Опухоль может быть расположена на конце длинной кости (обычно в метафизе). Чаще всего она поражает проксимальный конец большеберцовой или плечевой кости или дистальный конец бедренной кости. Остеосаркома имеет тенденцию поражать области вокруг колена в 60% случаев, вокруг бедра в 15%, плечо в 10% и челюсть в 8%. Опухоль твердая, твердая и нерегулярная, потому что опухолевые спикулы в кальцинированной кости расходятся под прямым углом («елочка», «изъеденный молью» или «закат» на рентгеновском снимке). Эти прямые углы образуют то, что известно как треугольник Кодмана; это характерный, но не диагностический признак остеосаркомы.
Диагностика остеосаркомы:
Рентгеновские снимки являются предпочтительным методом начальной визуализации для диагностики остеосаркомы. Некоторые особенности остеосаркомы на рентгеновских снимках включают вид заката и треугольник Кодмана (подъем костной коры опухоли, вызывающий образование новой кости). КТ-сканирование полезно для определения анатомии кости, целостности костной коры, обнаружения патологического перелома и оценки оссификации (отложения нового костного материала) и кальцификации хряща. С другой стороны, мягкие ткани и костномозговая полость лучше визуализируются при МРТ-сканировании.
Биопсия при подозрении на остеосаркому должна проводиться квалифицированным ортопедом-онкологом. Американское онкологическое общество утверждает: «Вероятно, ни в каком другом случае рака не так важно, чтобы эта процедура была выполнена правильно». «Неправильно выполненная биопсия может затруднить спасение пораженной конечности от ампутации». Он также может метастазировать в легкие и в основном проявляется в виде одиночных или множественных круглых узелков в нижних отделах грудной клетки на рентгенограмме.
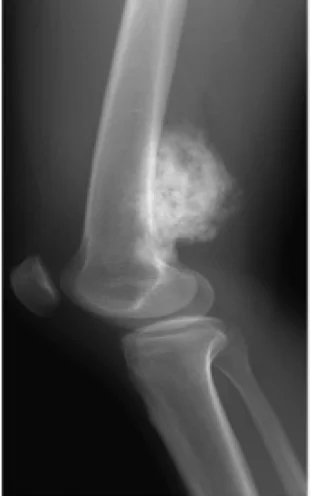
Типы остеосаркомы:
- Обычные: остеобластические, хондробластические, фибробластические
- Телангиоэктатические
- Мелкоклеточные
- Низкоуровневые центральные
- Периостальные
- Параостальные
- Вторичные
- Высокоуровневые поверхностные
- Внескелетные
Лечение остеосаркомы:
Полная хирургическая резекция рака единым блоком при остеосаркоме является предпочтительным методом лечения. Хотя большинство пациентов могут перенести операцию по сохранению конечности, осложнения (особенно инфекция, ослабление протеза и несращение перелома или локальный рецидив опухоли) могут привести к необходимости повторной операции или ампутации.
ПАЦИЕНТОВ С ОСТЕОСАРКОМОЙ ЛУЧШЕ ВЕДЕТ ОНКОЛОГ-ОРТОПЕД, ИМЕЮЩИЙ ОПЫТ ЛЕЧЕНИЯ САРКОМЫ. Текущим стандартным лечением является неоадъювантная химиотерапия (химиотерапия, проводимая перед операцией), за которой следует хирургическая резекция. Процент некроза опухолевых клеток (гибель клеток), наблюдаемый в опухоли после операции, дает представление о прогнозе, а также позволяет онкологу узнать, нужно ли менять схему химиотерапии после операции.
Стандартным лечением является ортопедическая операция с сохранением конечности (или ампутация в некоторых случаях), когда это возможно, и лейковориновая терапия с высокой дозой метотрексата, комбинация внутриартериального цисплатина, адриамицина, месны с ифосфамидом, BCD (блеомицин, циклофосфамид, дактиномицин), этопозид и мурамилтрипептид. Используемый протокол представляет собой агрессивный внутриартериальный режим, который индивидуализирует лечение на основе артериографического ответа. В некоторых исследованиях трехлетняя выживаемость без событий составляет от 50% до 75%, а пятилетняя выживаемость — от 60% до 85%. В целом, 65–70% пациентов, лечившихся пять лет назад, будут живы сегодня. Эти показатели выживаемости являются общими средними и сильно различаются в зависимости от индивидуальной скорости некроза.
Течение заболевания остеосаркомой:
Остеосаркома I степени встречается редко и включает в себя параостальную остеосаркому и низкосортную центральную остеосаркому. Она имеет отличный прогноз (>90%) при обширной резекции. Общий прогноз зависит от расположения опухоли (проксимальная большеберцовая кость, бедренная кость, таз и т. д.), размера опухолевой массы и степени некроза в результате неоадъювантной химиотерапии. Другие патологические факторы, такие как уровень P-гликопротеина, является ли опухоль cxcr4-положительной или Her2-положительной, также важны, поскольку они связаны с отдаленными метастазами в легкие. Показатели смертности от остеосаркомы снижаются примерно на 1,3% в год. Вероятность долгосрочной выживаемости при остеосаркоме значительно улучшилась в конце 20-го века, достигнув примерно 68% в 2009 году.





