Kemik Tümörleri
Kemik tümörlerine yönelik ortopedik tümör cerrahının ekibiyle (ortopedik tümör radyoloğu, ortopedik tümör patoloğu, damar cerrahı, yeterli bir rekonstrüksiyon tecrübesi olan mikrocerrah, radyasyon onkoloğu ve medikal onkolog) yapacağı uygun ve etkili bir çalışma hastanın tedavisinin yeterli olabilmesi için şarttır aksi halde yanlış tanı yada gecikmiş tanı ciddi sakatlıklar ve ölüm ile sonuçlanacaktır.
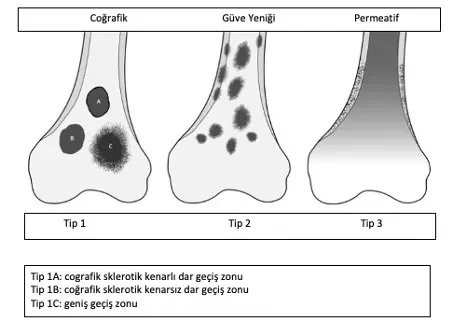
Hastanın şikayetine yönelik ayrıntılı bir hikaye alınması, ayrıntılı bir muayene ve klasik bir röntgen filmi ile tanı koyma başlar. İyi huylu tümörler genellikle şikayet oluşturmayan coğrafik, sklerotik kenarlı, kemik yıkımı yada periost reaksiyonu oluşturmayan lezyonlar olarak görülürler
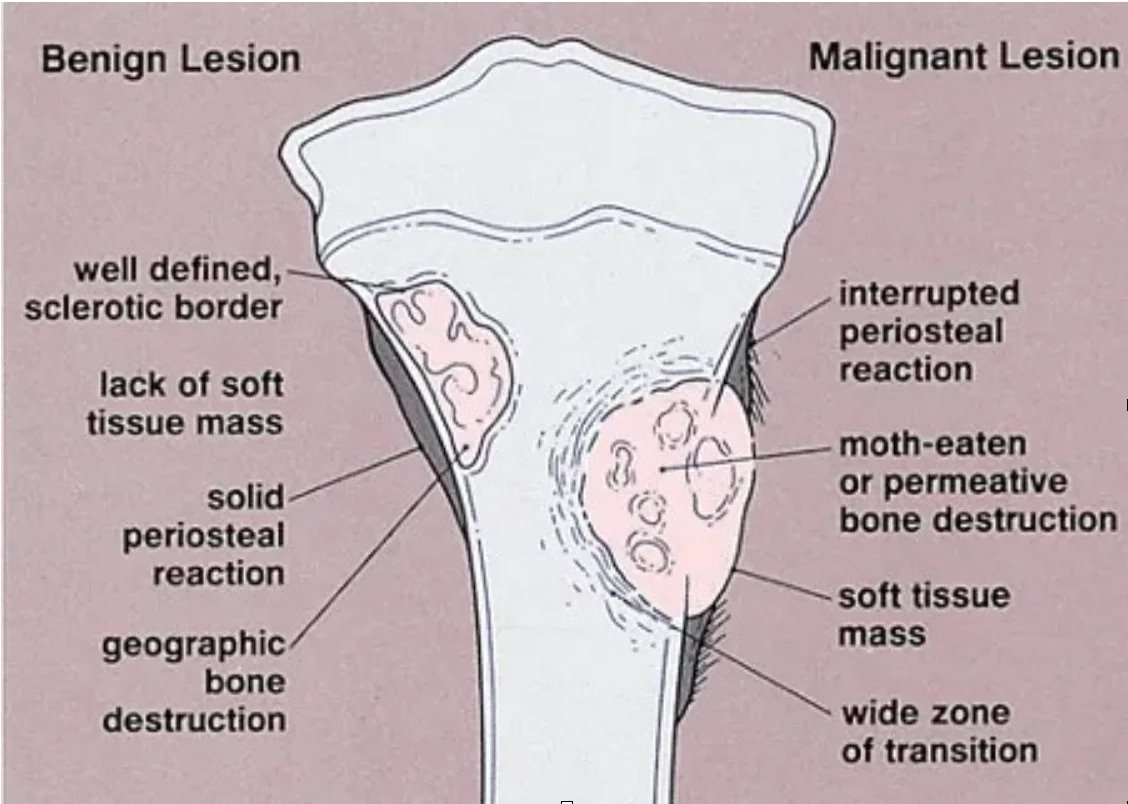
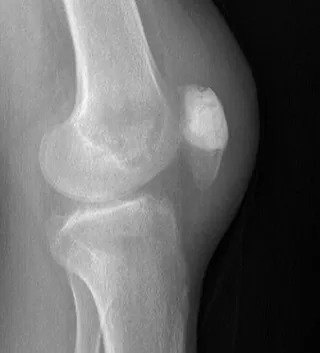
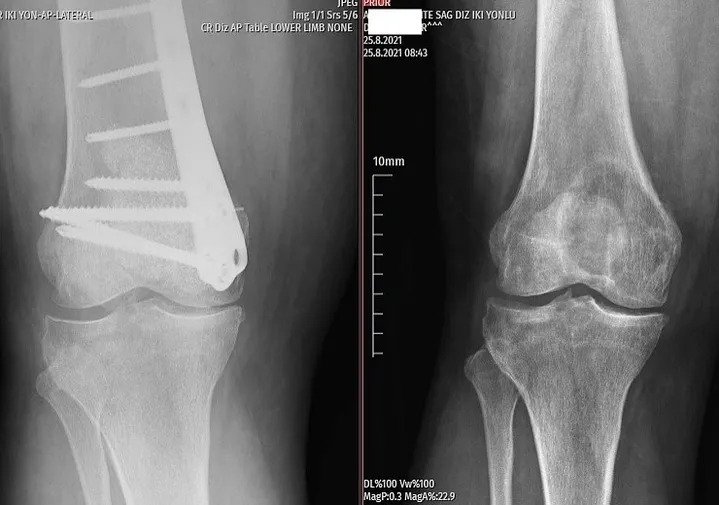
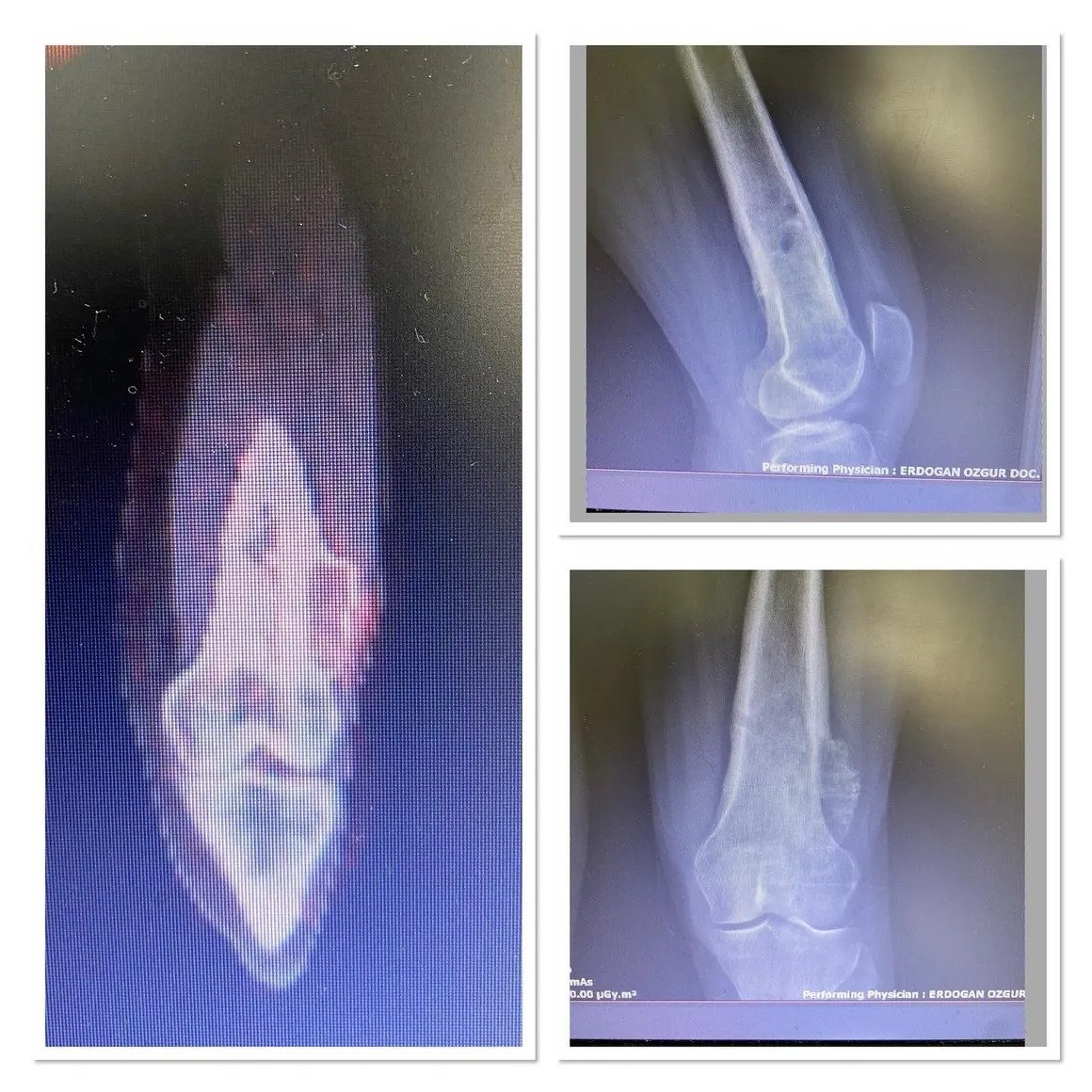
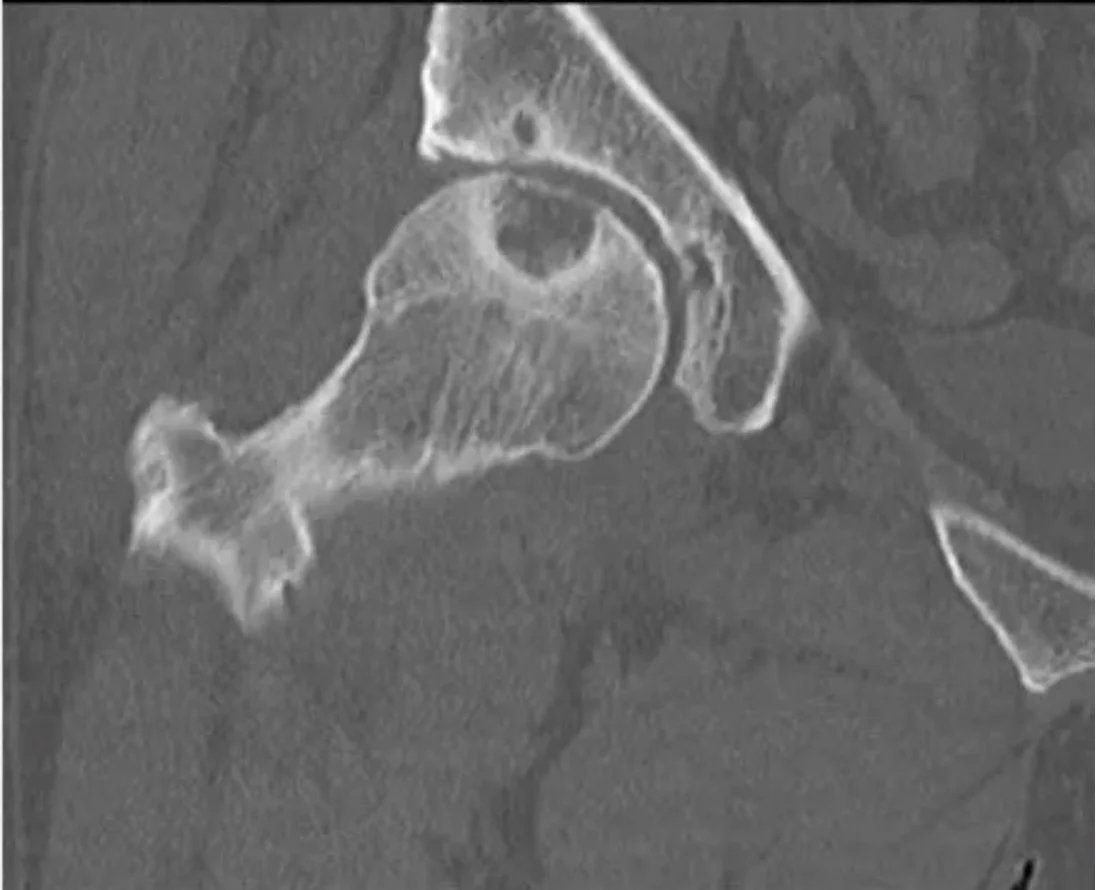
Kötü huylu tümörler ise bölgesel ağrı yaparlar, grafide litik, permeatif büyüme ve sağlam kemik ile kötü-belirsiz sınır gösterirler. Kemik zarı yıkımı ve/veya periost reaksiyonu (Resim 2) görülebilir.
Bu aşamada klasik bir ortopedi doktoru hastasını tümör ortopedisi uzmanına yönlendirmelidir. İleri görüntülemeler ve biyopsi tümör doktorunuz tarafından karar verilecek yöntemlerdir.
Kemik Tümörlerinin Kliniği
Klinik çok değişkendir. Hastalardaki lezyonlar kazara yada ağrı, şişlik gibi belirtilerle ortaya çıkabilir. Örneğin fibröz displazi yada osteokondromatozis hastalarda kemik eğriliği ile ortaya çıkabilir. Kemikte tümörle birlikte kırık, yumuşak doku kitlesi ve şişlik oluşabilir.Ağrılı lezyonlar genellikle agresif (iyi huylu ama saldırgan) ve potansiyel kötü huylu tümörlerde görülür. İyi ve kötü huylu tümörlerde klinik spekturum çok geniş olduğu için tanıda mutlaka tümör cerrahisinde tecrübeli bir hekime görünülmelidir. Yanlış ve yetersiz tanı ve tedaviler, basit bir takip veya tedaviyle yönetilebilecek bir hastayı, gereksiz, pahalı ve hasar bırakıcı test ve tedavilere maruz bırakacaktır. Aynı şekilde agresif ve kötü tümörlerin yetersiz tanı ve tedavisi kol-bacak kaybı yada can kaybı ile sonuçlanabilir.
İyi Huylu Tümörlerde Klinik
Ağrı kesici ile geçen orta şiddette bir ağrı bulunabilir. Ağrı yavaşça ortaya çıkar ve aktivite veya travma ile ilişkili olabilir. Örneğin osteoid osteomada ağrı kesicilere cevap veren gece ağrısı tipiktir. Normale kemiğin kırılmayacağı bir hareketle oluşan kırıklara patolojik kırık denir. Bazı iyi huylu lezyonlarda tek veya tekrarlayıcı travmalarla patolojik kırık gelişebilir. EĞER HASTANIN AĞRISI VEYA BELİRTİSİ YOKKEN LEZYON TESADÜFEN SAPTANMIŞSA BÜYÜK İHTİMALLE İYİ HUYLUDUR.
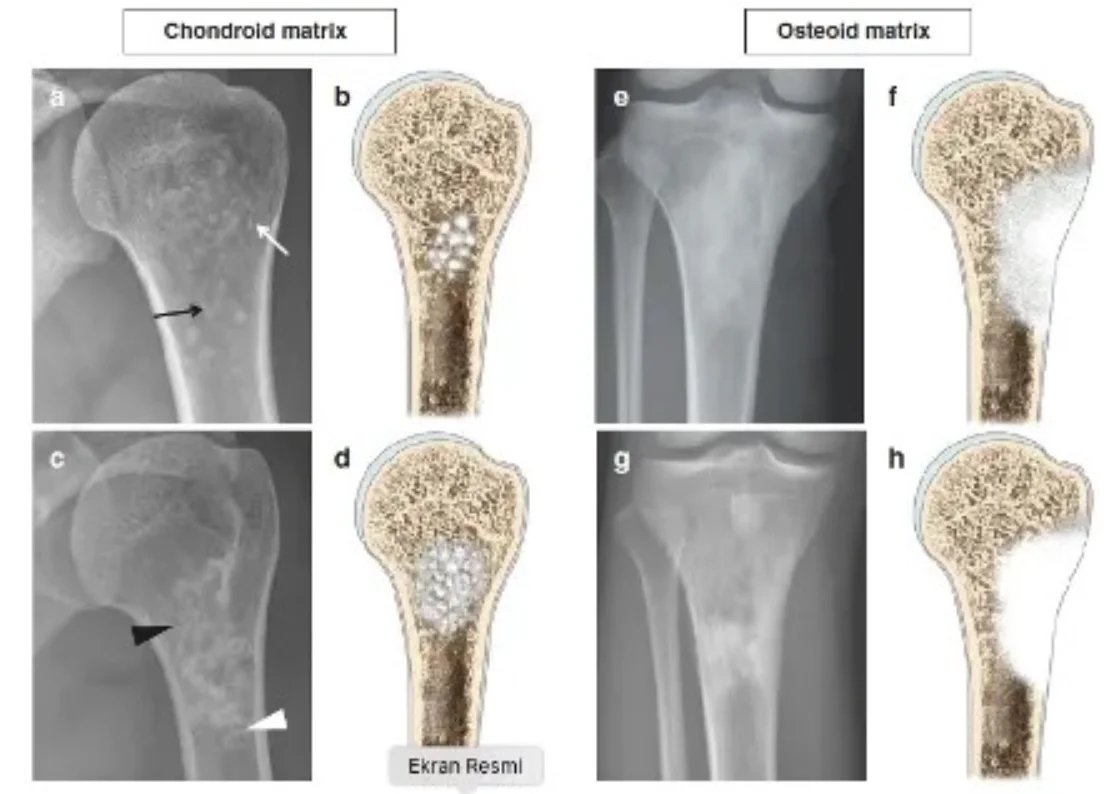
Tecrübeli bir tümör cerrahı hastanın yaşı lezyonun yeri ve röntgen ile lezyonun iyi mi yoksa biyopsi mi gerektirdiğini anlayacaktır. Radyolojik inceleme tüm kemiği içine almalıdır. İyi huylu tümörler tipik olarak coğrafik, dar geçiş zonlu ve sklerotik kenarlıdırlar (Resim 1). Endosteal incelme görülebilir ama korteks yıkımı nadirdir. Tanıda yardımcı bir diğer kriterde lezyonun matrixidir.
Emar yumuşak doku komponentini, kontrast madde tutulumunu, kemik iliği ödemini ve lezyonun sinyal karakteristiğini verir. Sintigrafi multipl kemik tutulumlarını görmek için poliostatik fibröz displazide, multipl enkondromatoziste ve histiyositoziste etkilidir. Soğuk bir sintigrafi lezyonun agresif yada malign olmadığını göstermez.( Ör. multipl myelom, renal cell ca metastazı). Ekleme komşu lezyonlarda dejeneratif ve aşırı kullanım lezyonları da ayırıcı tanıdadır.
Eğer korteks yıkımı, permeatif büyüme ve periost reaksiyonu varsa ileri inceleme şarttır. BT ve MR a rağmen tanı net değilse biyopsi gerekir.İyi huylu kemik tümörü tanısı konduktan sonra gözlem ve 3-6 ay aralıklarla radyolojik stabiliteden emin olmak için takip edilebilirler. Kemik yıkımını durdurmak, patolojik kırıkları tespit etmek yada kırılmak üzere olan lezyonları sağlamlaştırmak, deformiteleri önlemek için cerrahi girişim gerekecektir.
Kötü Huylu Tümörlerde Klinik
Klinik çok değişkendir. Hastalardaki lezyonlar kazara yada ağrı, şişlik gibi belirtilerle ortaya çıkabilir. Örneğin fibröz displazi yada osteokondromatozis hastalarda kemik eğriliGenellikle belirti verirler. Ağrı genelde ciddidir ve ağrı kesiciler yeterli olmaz. Aktivite ve dinlenme ile alakasız künt ve derin bir ağrı vardır. Patolojik kırık oluşursa ağrı ani olarak ortaya çıkar. Ayak ve bacaklarda uyuşma güçsüzlük bağırsak ve mesane çalışmasında bozukluklar omurga ve sakrum tümörlerinde görülürler. Eşlik eden bir şişlik olabilir. Yorgunluk, halsizlik ve ateş görülebilir. Laboratuarda artmış alkalen fosfataz, kalsiyum yüksekliği ve anemi görülebilir. Hikayede ailede kanser ve sarkom öyküsü önemlidir. Örneğin retinablastoma, Li Fraumeni sendromu ve Rothmund- Thompson sendromları osteosarkom gibi kemik tümörlerine hazırlayıcı etkiye sahiptirler. Multipl enkondromatozis lezyonlarının kötüye çevirebileceği bildirilmiştir. Ayrıca paget hastaları, radyoterapi geçmişi, kronik osteomyelit ve kemik enfarktı zemininde sarkom gelişebilmektedir. Biyopsiyi ortopedik tümör cerrahı yapmalıdır çünkü biyopsi mümkün olduğunca kapalı yapılmalıdır ve bu da tecrübe gerektirir. Ayrıca biyopsi yeri önemli damar ve sinirleri kirletmeyecek şekilde seçilmelidir. Biyopsi yeri esas tümör ameliyatında tümör cerrahının tercih edeceği çizgi üzerinde olmalıdır aksi halde çok ciddi kas ve doku kayıpları, tehlikeli damar nakilleri, sinir kayıpları ve cilt nakilleri gibi uzun ve ağır ameliyatlar gerekecektir. Bu da kol bacak kayıplarını arttıracak beklenen yaşam süresini kısaltabilecektir. Eğer kötü huylu kemik tümörü tanısı konduysa evreleme yapılmalıdır. Bunun için PET çekimi hızlıca gerçekleştirilmelidir. 40 yaş üzeri hastalarda genellikle lezyon metastatik karsinom, multipl myelom ya da lenfomadır. Ek olarak kadınlarda meme, erkeklerde prostat değerlendirilmeli serum ve idrarda protein elektroforezi yapılmalıdır. Tedavide ortopedik tümör cerrahının liderliğinde radyasyon ve medikal onkologların yer aldığı multidisipliner yaklaşım gerekir.ği ile ortaya çıkabilir. Kemikte tümörle birlikte kırık, yumuşak doku kitlesi ve şişlik oluşabilir.Ağrılı lezyonlar genellikle agresif (iyi huylu ama saldırgan) ve potansiyel kötü huylu tümörlerde görülür. İyi ve kötü huylu tümörlerde klinik spekturum çok geniş olduğu için tanıda mutlaka tümör cerrahisinde tecrübeli bir hekime görünülmelidir. Yanlış ve yetersiz tanı ve tedaviler, basit bir takip veya tedaviyle yönetilebilecek bir hastayı, gereksiz, pahalı ve hasar bırakıcı test ve tedavilere maruz bırakacaktır. Aynı şekilde agresif ve kötü tümörlerin yetersiz tanı ve tedavisi kol-bacak kaybı yada can kaybı ile sonuçlanabilir.
Yumusak Doku Tümörleri
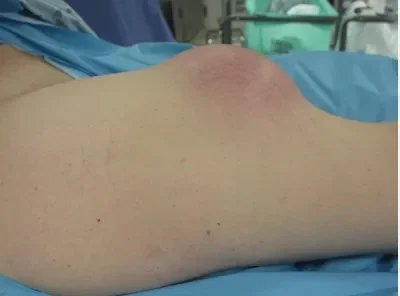
Yumuşak doku tümörleri kemik tümörlerine göre daha yaygındır ve sıklıkla iyi huyludur. Ayrıntılı bir hikaye ve muayene ile tanı koyma süreci başlar. Röntgen, emar, ultrason, BT ve PET ileri tetkik amacıyla kullanılır.Ayrıca bu araçlar tedavi cevabını değerlendirmede de kullanılırlar. İyi huyluları kötü huylulardan 100 kat daha sıktır. Hikaye ve muayenede kitlenin yeri, boyutu ve kıvamı önemlidir. Fasyaya göre derinliğine bakılır.
Sorulması gereken sorular:
- Kitle ne zaman farkedildi?
- Boyutunda büyüme var mı?
- Büyüme oranı nedir?
- Boyutta küçülmeler oluyor mu?
- Eşlik eden kitle var mı?
- Ağrı, ciltte kızarıklık bölgesel lenf nodu şişliği var mı?
- Ateş, titreme, gece terlemesi var mı?
Ayrıca travma, kan sulandırıcı kullanımı, geçirilmiş kanser, dünya seyahati gibi konularda sorgulanmalıdır.
KÜÇÜK, YUMUŞAK, YÜZEYSEL VE YILLARDIR STABİL BİR KİTLE ÇOK BÜYÜK İHTİMALLE İYİ HUYLUDUR.
BÜYÜK, SERT, DERİN VE BÜYÜME YAPAN KİTLELERİN KÖTÜ HUYLU OLMA İHTİMALİ YÜKSEKTİR.
Kan sulandırıcı kullananlarda hafif travmalarla hematomlar oluşabilir ama bu hematomlar altta yatan bir kanseri maskeleyebilir.
Kitlede ossifikasyon( kemikleşme) olması ayırıcı tanıya yardımcı olur. Örneğin myozitis ossifikans adı verilen travmaya bağlı iyi huylu kitlede ossifikasyon periferde (çevresel) olurken yumuşak doku osteosarkomunda (kötü huylu) merkezde olur. Kalsifikasyon ise ossifikasyona göre daha dezorganize bir görünüme sahiptir.Vasküler malformasyonlarda flebolitler ve bazı lipomlarda distrofik kalsifikasyonlar görülebilir. Eğer bu distrofik kalsfikasyon agresif görünümdeyse tanı son derece kötü huylu olan sinovyal sarkomu düşündürür. Multipl uniform kalsifikasyonlar eklem çevresinde ise akla sinovyal kondromatozis adı verilen iyi huylu bir tümör gelmelidir. Radyografide kitleye komşu çevre kemik dokuda görülecek agresif bir periosteal reaksiyon yada kortikal destrüksiyon kitlenin kötü olduğuna dair yüksek bir ihtimali düşündürmelidir. MR da T2 de yüksek sinyal, kitlenin 3 cm den büyük olması, fasyanın altında olması, çevresel ödem, kitle içi hemoraji, T1 de heterojenite, tümör nekrozu, kemik veya damar sinir invazyonu, periferal, nodüler, heterojen kontrastlanma kitlenin büyük ihtimalle kötü olduğunu gösterir.
Mr da ilaç kullanımı (kontrastlı emar) sayesinde hematomlar, kistik-solid ayrımı, kitle içerisindeki kistik nekrotik alanların belirlenmesi ve bu sayede en uygun biyopsi yeri ayırt edilir. Yalnız hem kistik kitleler hem de miksoid yapıdan zengin tümörler sıvı duyarlı sekanslarda parlayabilir. Bu kitleler ancak ilaçlı emar ile ayırt edilebilir. Kistik kitlelerde ilaç çevresel tutarken solid kitleler solid kontrast tutarlar.
Eğer ameliyat öncesinde radyoterapi ve/veya kemoterapi uygulandıysa tümörü ameliyat öncesinde yeni bir mr ile incelemek şarttır.Bu sayede tedavi cevabı anlaşılır. Bazen bu tedavilere rağmen kitle büyüyebilir bunun bir sebebi de kitlenin içerisinden ölmeye başlaması ve kanamasıdır bu da ilaçlı mr ile ortaya konabilir.
Sarkomlar
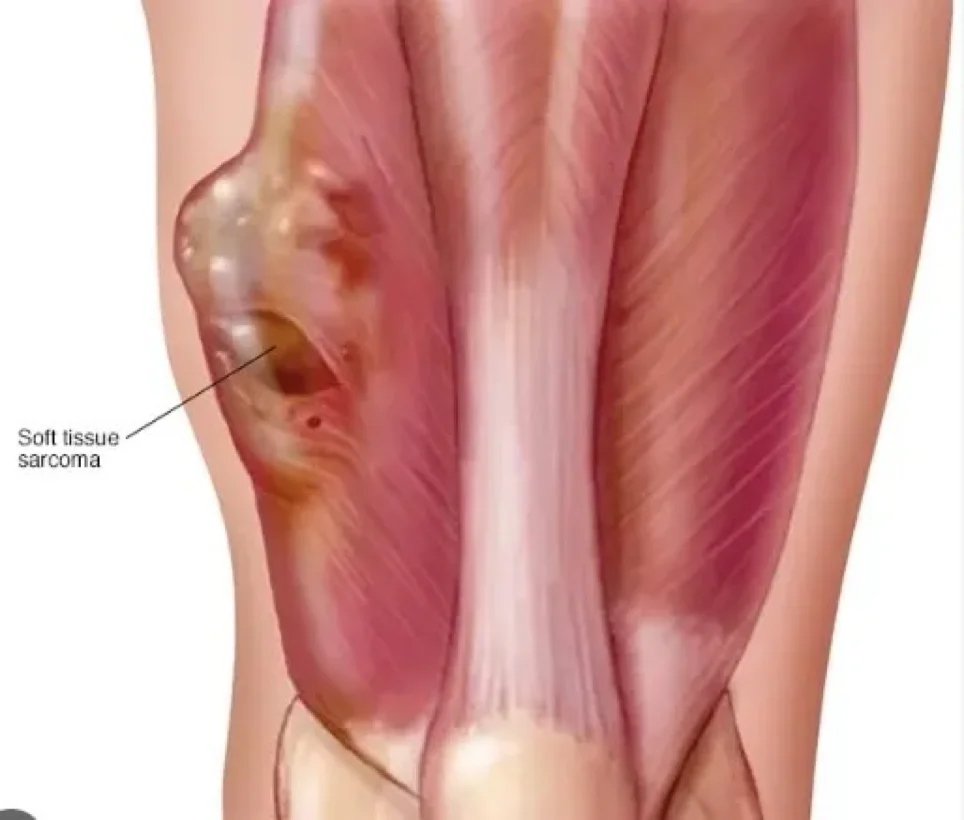
Sarkom, mezenkimal (bağ dokusu) kökenli dönüşmüş hücrelerden kaynaklanan bir kanser türü olan kötü huylu bir tümördür. Bağ dokusu, kemik, kıkırdak, yağ, vasküler veya hematopoietik dokuları içeren geniş bir terimdir ve bu doku türlerinin herhangi birinde sarkomlar ortaya çıkabilir. Sonuç olarak, tümörün köken aldığı spesifik doku ve hücre tipine göre sınıflandırılan birçok sarkom alt tipi vardır. Sarkomlar birincil bağ dokusu tümörleridir, yani bağ dokularından kaynaklanırlar.
Bu, vücudun başka yerlerinden (akciğerler, meme dokusu veya prostat gibi) bir kanser bağ dokusuna yayıldığında ortaya çıkan ikincil (veya “metastatik”) bağ dokusu tümörlerinin tersidir. Sarkom kelimesi Yunanca σάρκωμα sarkōma “etli dışkı veya madde” kelimesinden, kendisi de “et” anlamına gelen σάρξ sarx’tan türetilmiştir.
Sınıflandırma
Sarkomlar tipik olarak iki ana gruba ayrılır: her birinin birden fazla alt tipi olan kemik sarkomları ve yumuşak doku sarkomları[2]. Amerika Birleşik Devletleri’nde, Amerikan Kanser Ortak Komitesi (AJCC) sarkomun alt tiplerini sınıflandıran yönergeler yayınlar.
Bu alt tipler şu şekildedir:
Kemik sarkomunun alt tipleri:
- Osteosarkomkondrosarkom
- Az diferansiye yuvarlak/iğsi hücreli tümörler (Ewing sarkomu dahil)hemanjiyoendotelyoma
- anjiyosarkom
- Fibrosarkom/miyofibrosarkomkordoma
- Adamantinom
Diğerleri:
- Liposarkomleiomyosarkom
- Kötü huylu periferik sinir kılıfı tümörü
- Rabdomiyosarkom
- Sinovyal sarkom
- Malign soliter fibröz tümörü
Yumuşak doku sarkomunun alt tipleri:
- Liposarkom (şu türleri içerir: atipik lipomatoz tümör/iyi diferansiye liposarkom, dediferansiye liposarkom, miksoid liposarkom, pleomorfik liposarkom ve miksoid pleomorfik liposarkom
- Dermatofibrosarcoma protuberans (pigmentli çeşitleri içerir)
- Dermatofibrosarkoma protuberans, fibrosarkomatoz
- Dev hücreli fibroblastom
- Malign soliter fibröz tümör
- Enflamatuar miyofibroblastik tümör
- Düşük dereceli miyofibroblastik sarkom
- Fibrosarkom (yetişkin ve sklerozan epiteloid çeşitleri içerir)
- Miksofibrosarkom (önceden miksoid malign fibröz histiyositoma)
- Düşük dereceli fibromiksoid sarkom
- Yumuşak dokuların dev hücreli tümörüleiomyosarkom
- Malign glomus tümörü
- Rabdomiyosarkom (şu çeşitleri içerir: embriyonal, alveolar, pleomorfik ve iğsi hücre/sklerozan)
- Hemanjiyoendotelyoma (şu çeşitleri içerir: retiform, psödomiyojenik ve epitelioid)
- Yumuşak doku anjiyosarkomu
- İskelet dışı osteosarkom
- Gastrointestinal stromal tümör, malign (GIST)Malign periferik sinir kılıfı tümörü (epitelioid çeşidini içerir)
- Malign Triton tümörü
- Malign granüler hücreli tümör
- Kötü huylu ossifiye fibromiksoid tümör
- Başka türlü tanımlanmamış stromal sarkom
- Miyoepitelyal karsinom
- Malign fosfatürik mezenkimal tümör
- Sinoviyal sarkom (şu türleri içerir: iğsi hücreli, bifazik ve başka türlü tanımlanmamış)
- epiteloid sarkom
- Alveoler yumuşak kısım sarkomu
- Yumuşak dokunun berrak hücreli sarkomu
- İskelet dışı miksoid kondrosarkomİskelet dışı
- Ewing sarkomuInterdigitating dendritik hücre sarkomu
- Desmoplastik küçük yuvarlak hücreli tümör
- Ekstrarenal rabdoid tümör
- Perivasküler epiteloid hücreli tümör, başka türlü tanımlanmamış
- intimal sarkom
- Farklılaşmamış iğ hücresi sarkomu
- Farklılaşmamış pleomorfik sarkom
- Farklılaşmamış yuvarlak hücreli sarkom
- Farklılaşmamış epiteloid sarkom
- Farklılaşmamış sarkom, başka türlü tanımlanmamış.
Sarkom Belirtileri:
Kemik sarkomlarının semptomları tipik olarak, özellikle geceleri görülen kemik ağrısı ve tümör bölgesi çevresinde şişmeyi içerir.
Yumuşak doku sarkomlarının semptomları değişir, ancak genellikle sert, ağrısız topaklar veya nodüller olarak ortaya çıkarlar. Gastrointestinal stromal tümörler (yumuşak doku sarkomunun bir alt tipi) genellikle asemptomatiktir, ancak karın ağrısı, dolgunluk hissi veya bağırsak tıkanıklığının diğer belirtileri gibi belirsiz şikayetlerle ilişkilendirilebilir.
Nedenler ve risk faktörleri:
Çoğu kemik sarkomunun nedeni bilinmemektedir, ancak birkaç faktör artmış kemik sarkomu gelişme riski ile ilişkilidir. Daha önce iyonlaştırıcı radyasyona maruz kalma (önceki radyasyon tedavisi gibi) böyle bir risk faktörüdür. Bazı kanser kemoterapötik ilaçlarında bulunanlar gibi alkilleyici ajanlara maruz kalmak da kemik sarkomu riskini artırır. Li-Fraumeni sendromu, kalıtsal RB1 gen mutasyonları ve Paget kemik hastalığı dahil olmak üzere belirli kalıtsal genetik sendromlar, kemik sarkomları geliştirme riskinin artmasıyla ilişkilidir.
Yumuşak doku sarkomlarının çoğu, etkilenen kişinin hücrelerinde doktorların “sporadik” (veya rastgele) genetik mutasyonlar olarak adlandırdığı durumlardan kaynaklanır. Bununla birlikte, yumuşak doku sarkomu gelişme riskinin artmasıyla ilişkili belirli risk faktörleri vardır. Daha önce iyonlaştırıcı radyasyona maruz kalmış olmak böyle bir risk faktörüdür. Vinil klorür (örneğin, Polivinil klorür (PVC) üretiminde karşılaşılan dumanlar gibi), Arsenik ve Thorotrast’a maruz kalma, anjiyosarkom riskinin artmasıyla ilişkilidir. Bazı meme kanseri tedavilerinden kaynaklananlar gibi lenfödem de anjiyosarkom gelişimi için bir risk faktörüdür. Kemik sarkomlarında olduğu gibi, Li-Fraumeni sendromu, ailesel adenomatöz polipozis, nörofibromatozis tip 1 ve kalıtsal RB1 gen mutasyonları dahil olmak üzere bazı kalıtsal genetik sendromlar da yumuşak doku sarkomu geliştirme riskinin artmasıyla ilişkilidir. Kaposi sarkomuna Kaposi sarkomu ile ilişkili herpes virüsü (HHV-8) neden olur.
Mekanizmalar:
Sarkomla sonuçlanan kesin moleküler değişiklikler her zaman bilinmemekle birlikte bazı sarkom türleri, belirli genetik mutasyonlarla ilişkilidir.
Örnekler şunları içerir:
Çoğu Ewing sarkomu vakası, kromozom 11’in bir kısmının kromozom 22’nin bir kısmı ile birleştiği bir kromozomal translokasyon ile ilişkilidir.[2] Bu, Ewing vakalarının %90’ında FLI1 geni ve vakaların %5-10’unda ERG geni dahil olmak üzere EWS geninin diğer genlerle kaynaşmasına neden olur. Bu füzyonlar anormal proteinlerin üretilmesine neden olur, ancak bu anormal proteinlerin nasıl kansere yol açtığı tam olarak bilinmemektedir.
Dermatofibrosarkoma protuberans sıklıkla, COL1A1 geninin PDGFRB genine kaynaştığı bir kromozomal translokasyon ile ilişkilidir. Bu, hücre bölünmesini teşvik ettiği ve sonuçta tümör gelişimine yol açtığı düşünülen aşırı aktif PDGF sinyali ile sonuçlanır.
Enflamatuar miyofibroblastik tümör sıklıkla ALK geninin yeniden düzenlemeleri ve bazen de HMGA2 geninin yeniden düzenlemeleri ile ilişkilidir.
Yumuşak dokunun dev hücreli tümörü sıklıkla kromozom 1 ve kromozom 2 arasındaki kromozomal translokasyon ile ilişkilidir, burada CSF1 geni COL6A3 geni ile kaynaşır. Bu, kanser gelişiminde rol oynadığı düşünülen BOS1 protein üretiminin artmasına neden olur.
Pek çok liposarkom, 12. kromozomun bir kısmının duplikasyonu ile ilişkilidir, bu da CDK4 geni, MDM2 geni ve HMGA2 geni gibi bilinen kanseri teşvik eden genlerin (“onkogenler”) fazladan kopyaları ile sonuçlanır.
Teşhis:
Kemik sarkomları
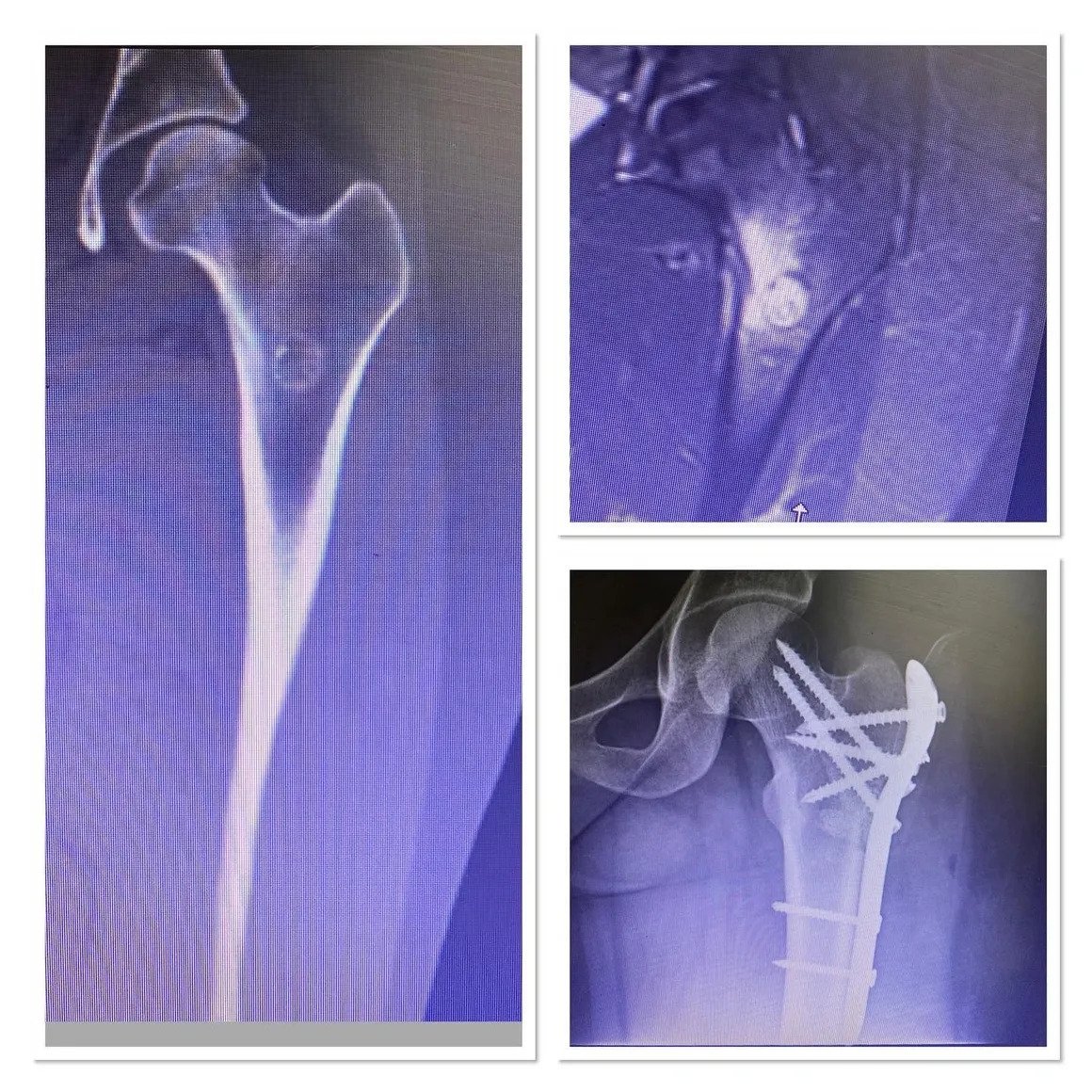
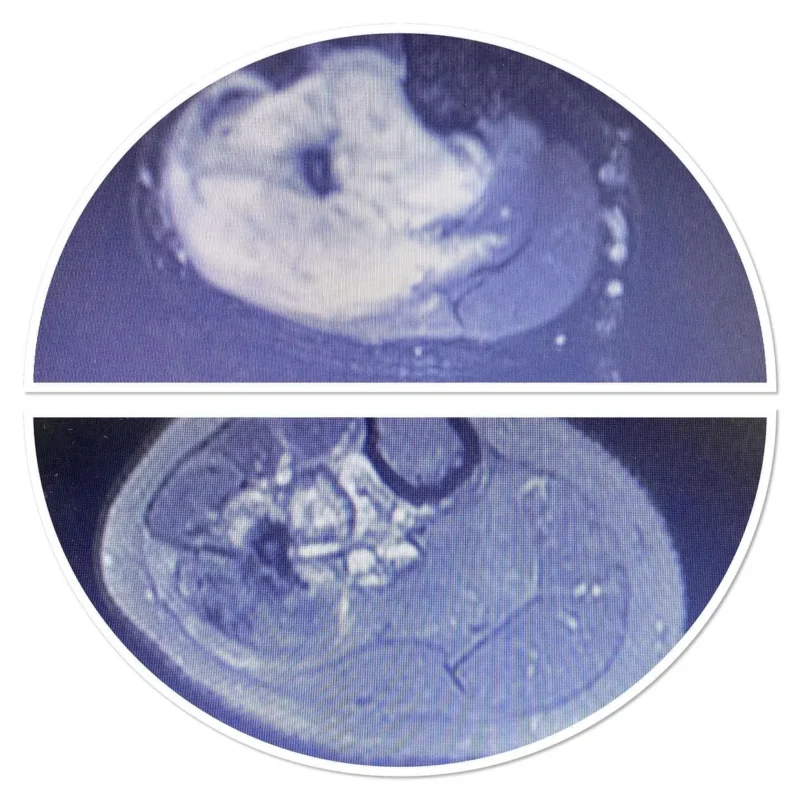
Kemik sarkomlarının teşhisi, karakteristik belirti ve semptomları ortaya çıkarabilen ayrıntılı bir öykü ve fizik muayene ile başlar (yukarıdaki Belirtiler ve Semptomlara bakın). Bazı kemik sarkomları (osteosarkom gibi) yüksek alkalen fosfataz seviyeleri ile, diğerleri (Ewing Sarkomu gibi) yüksek eritrosit sedimantasyon hızı ile ilişkilendirilebilse de laboratuvar çalışmaları teşhiste özellikle yararlı değildir. Ancak daha da önemlisi, bu laboratuvar bulgularının hiçbiri kemik sarkomlarına özgü değildir; bu, bu laboratuvar değerlerindeki yükselmelerin sarkomun yanı sıra diğer birçok durumla da ilişkili olduğu ve bu nedenle sarkomu kesin olarak teşhis etmek için güvenilemeyeceği anlamına gelir. Görüntüleme çalışmaları tanıda kritik öneme sahiptir ve çoğu klinisyen başlangıçta düz bir radyografi (röntgen) ister. Tanıda yaygın olarak kullanılan diğer görüntüleme çalışmaları arasında manyetik rezonans görüntüleme (MRI) çalışmaları ve radyoizotop kemik taramaları yer alır. Evreleme için önemli bir araç olmasına rağmen bilgisayarlı tomografi (BT) görüntüleme tipik olarak çoğu kemik sarkomu tipinin tanısında kullanılmaz. Kesin tanı, tümörün biyopsisini ve biyopsi örneğinin deneyimli bir patolog tarafından dikkatli bir şekilde incelenmesini gerektirir.
Yumuşak doku sarkomları
Yumuşak doku sarkomlarının teşhisi de kapsamlı bir öykü ve fizik muayene ile başlar. Görüntüleme çalışmaları BT veya MRG’yi içerebilir, ancak BT toraks, karın veya retroperitonda yer alan yumuşak doku sarkomları için tercih edilme eğilimindedir. Pozitron emisyon tomografisi (PET) de tanıda yararlı olabilir, ancak en yaygın kullanımı evreleme içindir. Kemik sarkomlarında olduğu gibi kesin tanı biyopsi ve eğitimli bir patolog tarafından histolojinin değerlendirilmesini gerektirir.
Evreleme:
Genel olarak kanser evrelemesi, bir kanserin ne kadar ilerlemiş olduğunu ifade eder ve genellikle tümörün boyutu ve vücudun diğer bölgelerine yayılıp yayılmadığı gibi faktörlere dayanır. Evreleme önemlidir çünkü evre prognozu (muhtemel sonuç) ve ayrıca kansere karşı etkili olması muhtemel tedavi türlerini etkiler. Sarkomlarda evrelemede, tümörün çevre dokulara büyüyüp büyümediği (lokal invazyon), lenf düğümlerine (nodal metastazlar) yayılıp yayılmadığı veya vücuttaki diğer doku veya organları (uzak metastaz) istila edip emediğine bakılır.
Kemik sarkomlarını evrelemek için kullanılan en yaygın görüntüleme araçları, birincil tümörü değerlendirmek için MRI veya BT, kanserin akciğerlere yayılıp yayılmadığını (yani metastaz yapıp yapmadığını) değerlendirmek için göğüsün kontrastlı BT’si ve kemik metastazlarını değerlendirmek için radyoizotop kemik taramasıdır. Yumuşak doku sarkomları için evreleme, tipik olarak, tümör boyutunu belirlemek için birincil tümörün MRI veya BT ile görüntülenmesinin yanı sıra akciğerlerdeki metastatik tümörleri değerlendirmek için kontrastlı göğüs BT’sini içerir.
Grade (Derece):
Diğer bazı kanserler gibi sarkomlara da mikroskop altında tümör hücrelerinin görünümüne göre bir derece (düşük, orta veya yüksek) atanır. Genel olarak derece, kanserin ne kadar agresif olduğunu ve vücudun diğer bölgelerine yayılma (“metastaz”) olasılığını ifade eder. Düşük dereceli sarkomlar, yüksek dereceli sarkomlardan daha iyi bir prognoza sahiptir ve genellikle cerrahi olarak tedavi edilir. Orta dereceli ve yüksek dereceli sarkomlar daha sıklıkla cerrahi, kemoterapi veya radyasyon terapisinin bir kombinasyonu ile tedavi edilir. Yüksek dereceli tümörlerin metastaz yapma (istila ve bölgesel ve uzak bölgelere yayılma) olasılığı daha yüksek olduğundan, daha agresif bir şekilde tedavi edilirler. Pek çok sarkomun kemoterapiye duyarlı olduğunun bilinmesi, hastaların sağkalımını önemli ölçüde iyileştirmiştir. Örneğin, kemoterapi öncesi dönemde, lokalize osteosarkoma sahip pediatrik hastalarda uzun süreli sağkalım sadece %20 iken, şimdi %60-70’e yükselmiştir.
Tedavi
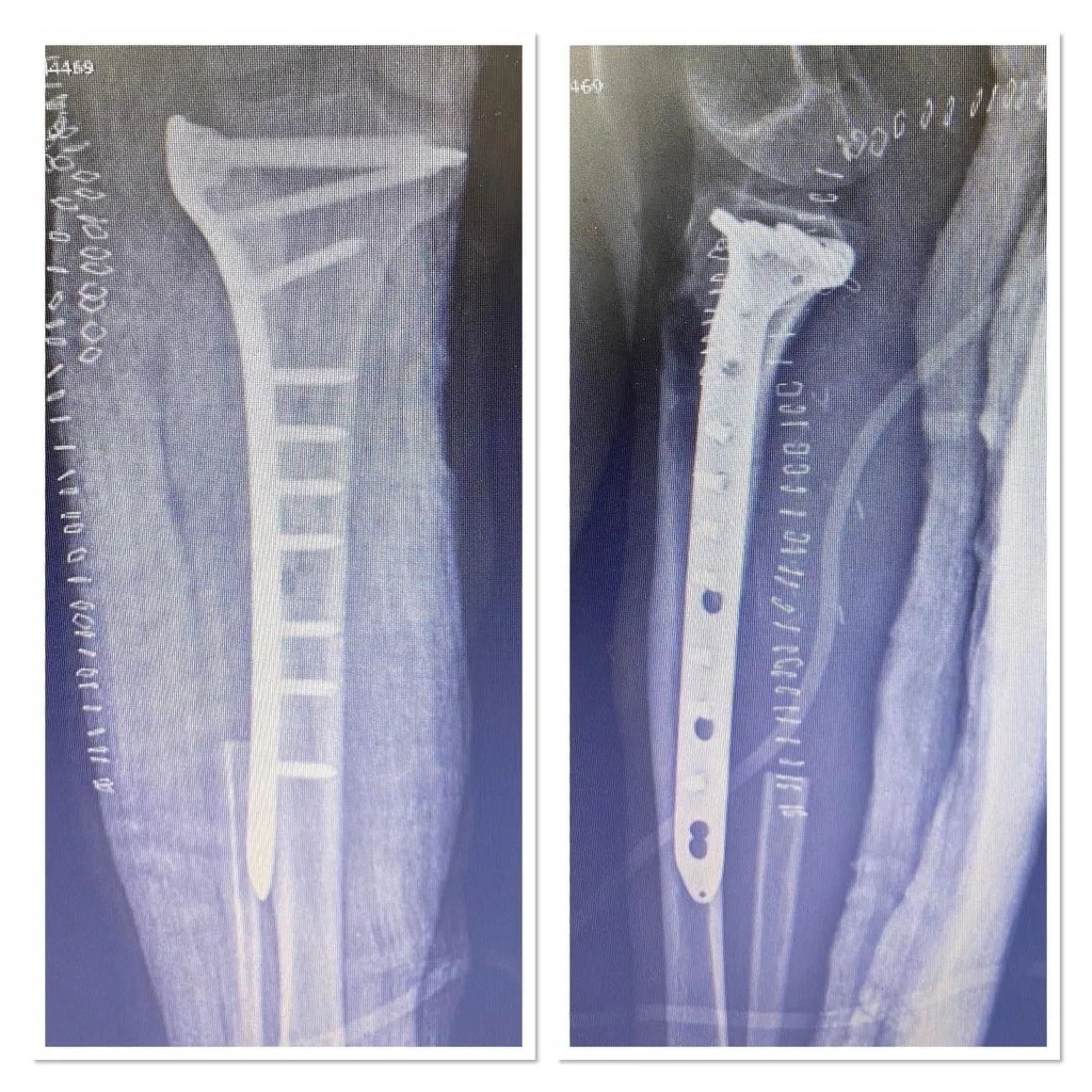
Vücudun diğer bölgelerine yayılmamış çoğu sarkom için en yaygın tedavi cerrahidir. Artık ekstremite (kol veya bacak) sarkomu vakalarının en az %90’ında hastaların uzuvlarını kurtarmak için amputasyonun aksine uzuv koruyucu cerrahi uygulamaktayız. Kemoterapi, radyasyon tedavisi (“radyoterapi” olarak da adlandırılır) ve proton tedavisi dahil olmak üzere ek tedaviler, ameliyattan önce (“neoadjuvan” kemoterapi veya radyoterapi olarak adlandırılır) veya ameliyattan sonra (“adjuvan” kemoterapi veya radyoterapi olarak adlandırılır) uygulanabilir. Neoadjuvan veya adjuvan kemoterapi ve radyoterapi kullanımı birçok sarkom hastasının prognozunu önemli ölçüde iyileştirmiştir. Tedavi birçok hasta için yaklaşık bir yıl süren uzun ve meşakkatli bir süreç olabilir.
Prognoz
Prognozu etkileyen faktörler
AJCC, kemik sarkomlarının prognozunu etkileyen birkaç faktör belirlemiştir:
Tümörün boyutu: Daha büyük tümörler, daha küçük tümörlere kıyasla daha kötü bir prognoza sahip olma eğilimindedir.
Tümörün çevre dokulara yayılması: Lokal olarak çevre dokulara yayılmış tümörler, menşe yerlerinin ötesine yayılmayan tümörlere kıyasla daha kötü bir prognoza sahip olma eğilimindedir.
Metastazların evresi ve varlığı: Lenf düğümlerine (kemik sarkomları için nadirdir) veya diğer organlara veya dokulara (örneğin akciğerlere) yayılmış (“metastaz yapmış”) tümörlerin prognozu, yayılmamış tümörlere kıyasla daha kötüdür.
Tümör derecesi: yüksek dereceli tümörler (2. ve 3. dereceler), düşük dereceli (1. derece) tümörlere kıyasla daha kötü bir prognoza sahip olma eğilimindedir.
İskelet yerleşimi: Omurga veya pelvik kemiklerden kaynaklanan tümörler, kol veya bacak kemiklerinden kaynaklanan tümörlere kıyasla daha kötü bir prognoza sahip olma eğilimindedir.
GİST dışındaki yumuşak doku sarkomları için prognozu etkileyen faktörler şunlardır:
Derece: AJCC, yüksek dereceli tümörlerin düşük dereceli tümörlere kıyasla daha kötü prognoza sahip olduğu yumuşak doku sarkomları için Fransız Kanser Merkezleri Federasyonu Sarkom Grubu (FNCLCC) Derecesi adı verilen bir derecelendirme sisteminin kullanılmasını önerir.
GIST’ler için prognozu etkileyen anahtar faktör:
Mitotik hız: mitotik hız, tümör içinde aktif olarak bölünen hücrelerin fraksiyonunu ifade eder; Yüksek mitoz oranına sahip GİST’ler, düşük mitoz oranına sahip GİST’lere göre daha kötü prognoza sahiptir.
Sonuç Verileri
ABD Ulusal Kanser Enstitüsü (NCI) tarafından yayınlanan verilere göre, kemik sarkomları için genel 5 yıllık sağkalım %66,9’dur. Amerikan Kanser Derneği (ACS), ABD’de 2019’da 1.660 kişinin kemik sarkomlarından öleceğini tahmin ediyor ve bu, tüm kanser ölümlerinin %0,3’ünü oluşturuyor. Ortalama ölüm yaşı 61’dir, ancak ölüm her yaş grubunda meydana gelebilir. Böylece kemik sarkomu ölümlerinin %12,3’ü 20 yaş altı kişilerde, %13,8’i 20-34 yaş arası kişilerde, %5,5’i 35-44 yaş arası kişilerde, %9,3’ü 45-54 yaş arası kişilerde, %13,5’u 55-64 yaş arası kişilerde, %16,2’si 65-74 yaşındaki kişilerde, %16,4’ü 75-84 yaşındaki kişilerde ve %13,1’i 85 yaş ve üzerindeki kişilerde görülür.
Yumuşak doku sarkomları için genel 5 yıllık sağkalım (evreden bağımsız olarak) %64,5’tir, ancak sağkalım evre dahil birçok faktörden etkilenir. Bu nedenle, 5 yıllık sağkalım, birincil tümörün ötesine yayılmayan yumuşak doku sarkomları (“lokalize” tümörler) için %80,8, yalnızca yakındaki lenf düğümlerine yayılmış yumuşak doku sarkomları için %58,0 ve uzak organ yayılımı olan yumuşak doku sarkomları için %16,4’tür. ACS, 2019’da 5.270 kişinin yumuşak doku sarkomundan öleceğini tahmin ediyor ve bu, tüm kanser ölümlerinin %0,9’unu oluşturuyor.
Epidemiyoloji
Sarkomlar oldukça nadirdir. Önceden sağlıklı olan bir kişinin yeni bir kemik kanseri tanısı alma riski %0,001 (100.000 de 1)’den azken, yeni bir yumuşak doku sarkomu tanısı alma riski %0,0014 ile 0,005 arasındadır. Amerikan Kanser Derneği, Amerika Birleşik Devletleri’nde 2019’da 3.500 yeni kemik sarkomu vakası ve 12.750 yeni yumuşak doku sarkomu vakası olacağını tahmin ediyor. Tahmini toplam yeni kanser teşhisi sayısının (tüm kanser türleri) 1.762.450 olduğu düşünüldüğünde, bu, kemik sarkomlarının tüm yeni kanser teşhislerinin yalnızca %0,2’sini temsil ettiğini (onları en yaygın 30. kanser türü yapar) gösteriyor. Yumuşak doku sarkomları ise 2019’da ABD’deki tüm yeni kanser teşhislerinin yalnızca %0,7’sini temsil ediyor (onları en yaygın 22. kanser türü yapıyor).
Sarkomlar her yaştan insanı etkiler. Kemik sarkomlarının yaklaşık %50’si ve yumuşak doku sarkomlarının %20’si 35 yaşın altındaki kişilerde teşhis edilir. Leiomyosarkom, kondrosarkom ve gastrointestinal stromal tümör (GİST) gibi bazı sarkomlar erişkinlerde çocuklara göre daha sık görülür. Ewing sarkomu ve osteosarkom da dahil olmak üzere yüksek dereceli kemik sarkomlarının çoğu çocuklarda ve genç erişkinlerde çok daha yaygındır.
Tedavi:
Sarkomun tedavisi, özellikle sarkom yayıldığında veya “metastaz yaptığında”, genellikle kemoterapi gerektirir, ancak mevcut kemoterapötik ilaçlar önemli toksisitelerle ilişkilidir ve kanser hücrelerini öldürmede tam etkili değildir. Bu nedenle, sarkomu tedavi etmek için yeni ilaçları belirlemeye yönelik araştırmalar 2019 yılı itibarıyla yürütülmektedir. Bir olasılık, sarkomları tedavi etmek için kanser immünoterapisinin (örneğin, anti-PD1, anti-PDL1 ve anti-CTLA4 ajanları gibi immün kontrol noktası inhibitörleri) kullanılmasıdır. Bu henüz yerleşik bir tedavi aracı değildir. Küçük molekül hedefli terapi, biyolojik ajanlar (örn. küçük interfering RNA molekülleri) ve nanopartikül odaklı terapi gibi diğer stratejiler de araştırılmaktadır.
Dr Sameer Rastogi ve ark. immünoterapide birkaç sarkomda (UPS & ASPS) uzun süreli yanıtlar göstermiştir.
Sarkomun gelişmesine neden olan spesifik genetik ve moleküler faktörleri anlamaya yönelik araştırmalar devam etmektedir. Bu, yeni hedefe yönelik tedavilerin tasarlanmasına ve doktorların bir hastanın prognozunu daha doğru bir şekilde tahmin etmesine izin verebilir.
Tümör hücrelerinde H3-B3 immünoregülatör kontrol noktası reseptörünün varlığı, yeni ilaçların ve hedeflenen ajanların ve geliştirme aşamasındaki immünoterapilerin klinik deneme testi için fırsat sağlar.
Farkındalık:
ABD’de Temmuz ayı, yaygın olarak Sarkom Farkındalık Ayı olarak kabul edilmektedir. Birleşik Krallık’ta Temmuz ayında kemik ve yumuşak doku kanseri hayır kurumu Sarcoma UK liderliğinde bir Sarkom Farkındalık Haftası vardır.
Amerikalı YouTuber Technoblade’e Ağustos 2021’de sarkom teşhisi kondu ve kanser metastaz yaptıktan sonra Haziran 2022’de hastalığından ötürü hayatını kaybetti. Bir yardım kampanyasında 500.000 doların üzerinde para toplamıştı. Birçok YouTuber, Technoblade’e teşhis konup vefat ettikten sonra farkındalığı artırdı ve Amerika Sarcoma Vakfı gibi hayır kurumlarına bağışta bulundu.
Biyopsi
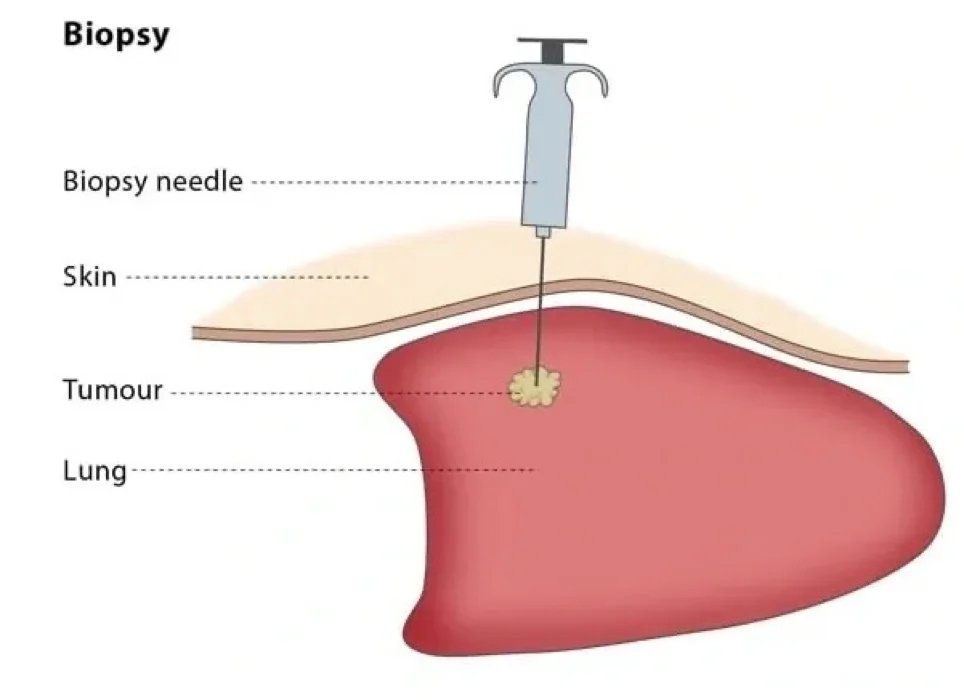
Kas iskelet sistemi tümörlerinin tanı ve tedavisinde en önemli aşamalardan birisi de biyopsidir. İyi planlanmış ve yapılmış bir biyopsi hastalık nedeniyle oluşabilecek sakatlıkları en aza indirecektir. Halk arasında tümöre bıçak vurulmaz inancı yaygındır. Aslında bunun doğru olduğu kanaatindeyim. Bu nedenle açık biyopsileri nadiren yapmaktayız.
Son yıllarda özel iğneler vasıtası ile tümörü açmadan alınan küçük örnekleri bu işte tecrübeli patoloji hocaları ile değerlendirdiğimizde yüksek doğruluk oranları ile tanı koymaya başladık. Iğne ile ve kapalı yöntemle ile biyopsi aldığımız için tümör hücrelerinin etrafa saçılımı da minimum seviyede olmaktadır. Zaten tümör cerrahisinin ana prensibi tümörü görmeden, tümörün içine girmeden çevrede bir miktar sağlıklı doku bırakarak kitleyi çıkarmaktır. Yani tümöre gerçekten bıçak vurulmamalıdır.
Biyopsi Prensipleri:
- Kanser tanısı olmadan kanser ameliyatı yapılmaz.
- Biyopsi öncesi klinik ve radyolojik değerlendirme tam olmalı
- Iyi huylu kitleler kötü huylulardan çok daha sık olsa da her zaman kanser tanısı göz önünde bulundurulmalıdır.
- Kapalı biyopsi çoğu durumda yeterlidir ve tercihedilmelidir.
- Eğer açık biyopsi yapılacaksa mutlaka ameliyatı da yapacak olan cerrah tarafından yapılmalıdır.
- Eksizyonel biyopsi adı verilen yöntem (parça almadan tüm kitleyi biyopsi materyali kabul edip geniş rezeksiyon yapmak) sadece özel durumlarda yapılmalıdır.
- Sarkom tanı ve tedavisi ekip işidir. İşi ehil ellere bırakmak gerekir.
Eğer bu prensiplere uyulursa hastaya en az zarar verilerek en doğru tanıya ulaşılabilir. Bunlar:
- Lipomlar( yağ bezeleri): eğer lezyon tüm sekanslarda homojen ve yağ doku ile izointens ise biyopsi gerekmez
- Tipik radyolojisi olan iyi huylu kemik tümörleri (ostekondromlar, non-ossifiying fibromlar, enkondromlar, unikamaral basit kemik kistleri) Hatta bu lezyonlarda kaliteli röntgenler ile ileri incelemeye gerek kalmayabilir.
- Tipik mr bulgusu olan yumuşak doku kitleleri) lipomlara ek olarak schwannomlar, hemanjiyomlar, arteriovenöz malformasyonlar, miksomalar.
- Biyopsi ile kanıtlanmış karsinom yada myelom hastalarındaki metastatik lezyonlar
Yumuşak doku biyopsilerini genellikle lokal anestezi altında, ofis şartlarında yapıyorum. Yaklaşık on dakikalık bir süre zarfında, minimum ağrı hissi ile, iğne ile biyopsi işlemini gerçekleştiriyorum. Hasta aynı gün işine dönebiliyor. Kapalı iğne biyopsilerinde bu konudaki en tecrübeli hocalarımızdan biriyle çalışıyor olsam da nadiren tanı konulamayabiliyor. Bu konuda bazı yazarlar açık biyopsiye geçilmesini bazıları ise tanı konulana kadar kapalı biyopsiye devam edlmesini savunmaktalar. Kişisel olarak 2 kez kapalı biyopsi deneyip yine tanı konulamazsa açık biyopsiye geçmeyi tercih ediyorum.
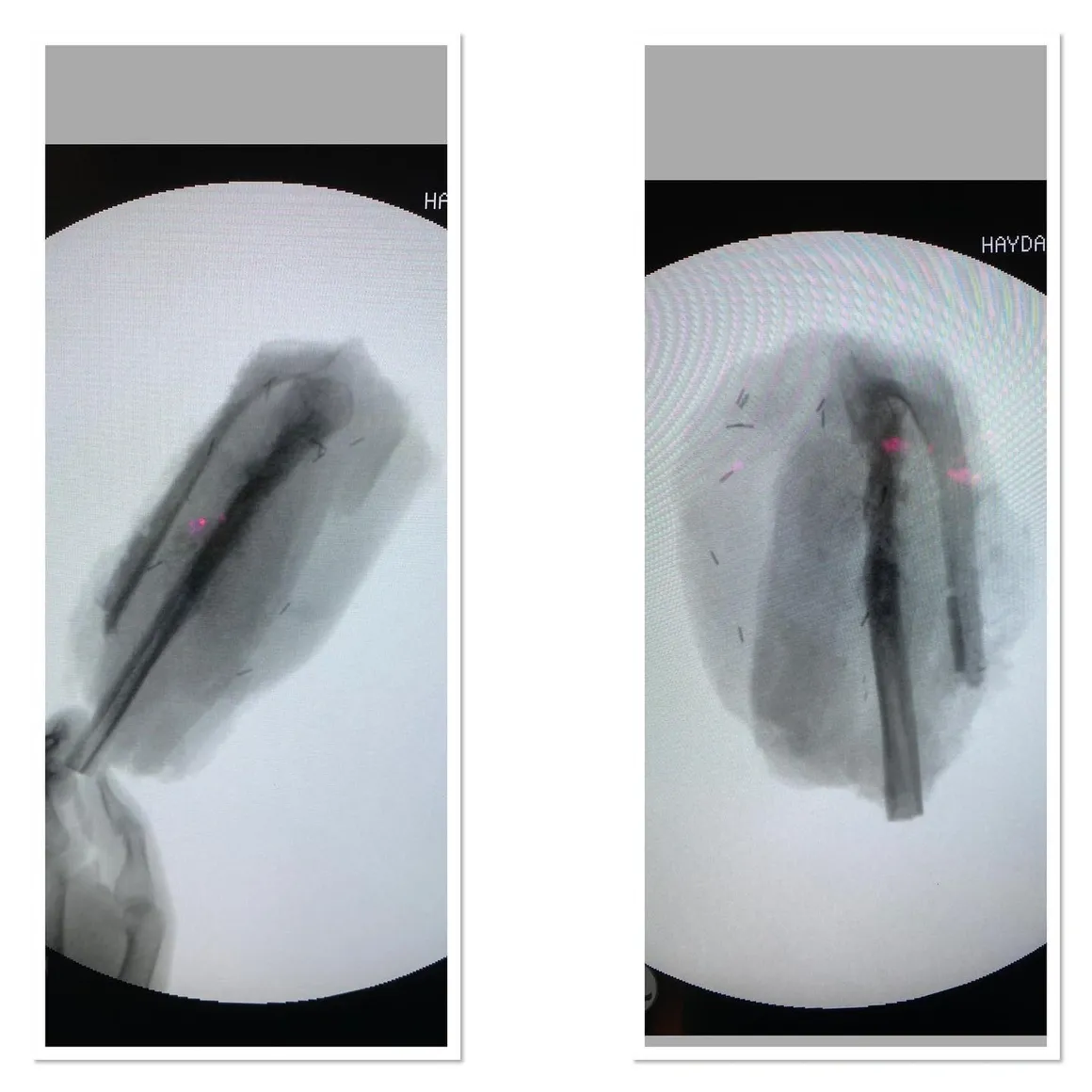
Kemik biyopsilerini ise yine tercihen kapalı iğne biyopsisi şeklinde, skopi görüntülemesi altında ameliyathanede yapıyorum. Hastanın hiç ağrı duymayacağı şekilde genel anestezi altında yaklaşık 15 dakikalık bir işlemle biyopsi örneklerini alıyorum.
Eğer hastada işlem öncesi yapılan görüntülemeler, kan testleri ya da muayenede enfeksiyondan da şüpheleniliyorsa , antibiyotikler kesilmeli, en az iki hafta beklenmeli ve aerob, anaerob, asit-fast bakteriler ve mantarlara yönelik kültür yapılmalıdır. Eskiden her biyopsiden kültür, her kültürden biyopsi alınmalı yaklaşımı yaygındı. Ama modern görüntüleme ve laboratuar yöntemleri sayesinde biyopsi yapılan hastalarda enfeksiyon olasılığı olanları oldukça daraltma imkanı doğmuştur.Gereksiz kültürler yanlış enfeksiyon tanılarına sebep olabilir bu da hastayı uzun, yorucu ve pahalı antibiyotik tedavilerine maruz bırakabilir.