أورام العظام
يعد إجراء دراسة مناسبة وفعالة لأورام العظام من قبل جراح أورام العظام بالتعاون مع فريقه (أخصائي أشعة أورام العظام، أخصائي علم أمراض أورام العظام، جراح الأوعية الدموية، الجراح المجهري ذو الخبرة الكافية في إعادة البناء، أخصائي العلاج الإشعاعي، وأخصائي الأورام الطبية) أمرًا ضروريًا لضمان علاج المريض بشكل كافٍ، وإلا فقد يتلقى المريض علاجًا غير صحيح. يمكن أن يؤدي التشخيص الخاطئ أو المتأخر إلى إعاقات خطيرة وحتى الوفاة.
يبدأ التشخيص بأخذ تاريخ مفصل لشكوى المريض، يليه فحص دقيق وصورة أشعة سينية كلاسيكية. تُرى الأورام الحميدة عمومًا على شكل آفات لا تسبب أي شكاوى، ولها سمات جغرافية، وحواف متصلبة، ولا تؤدي إلى تدمير العظام أو تفاعل السمحاق.
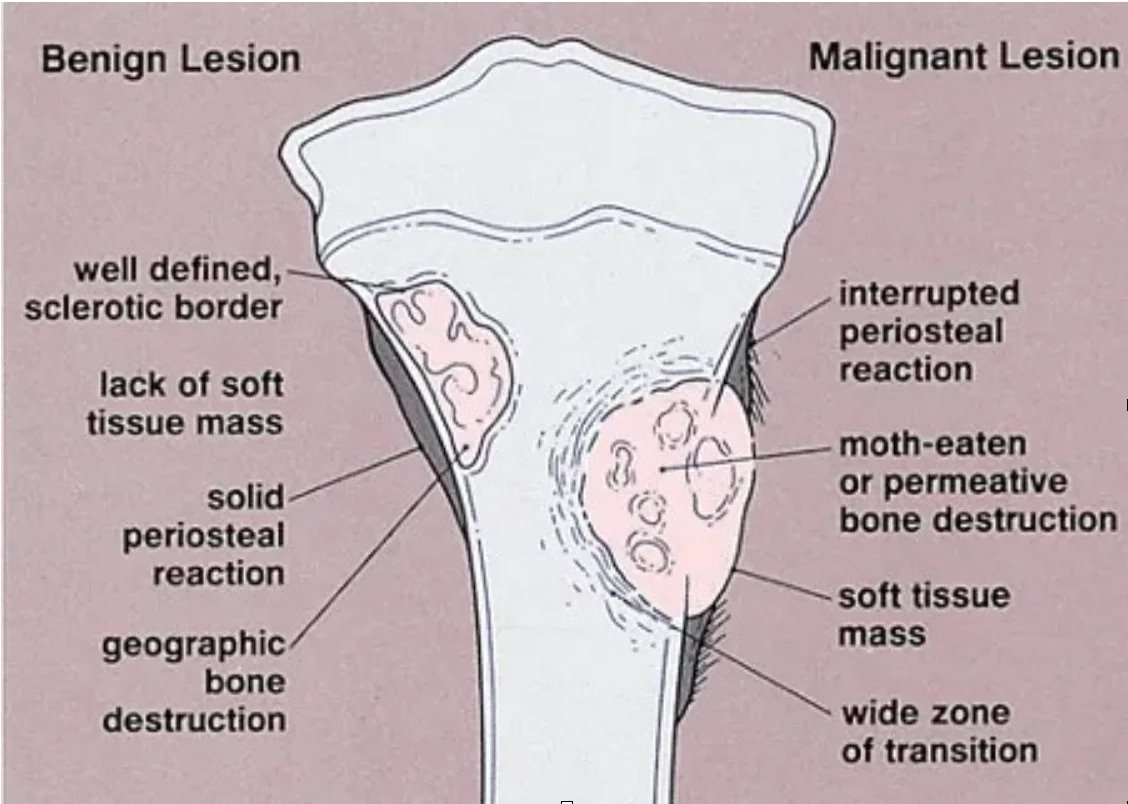
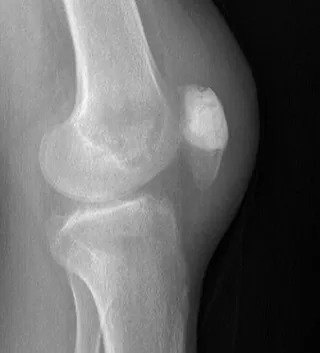
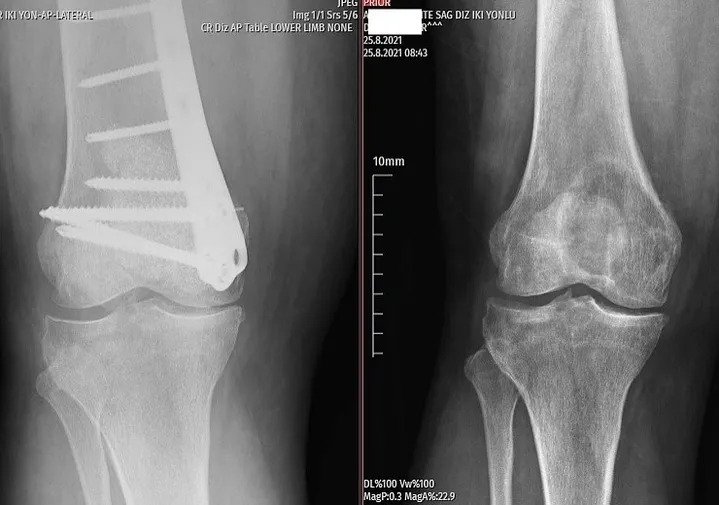
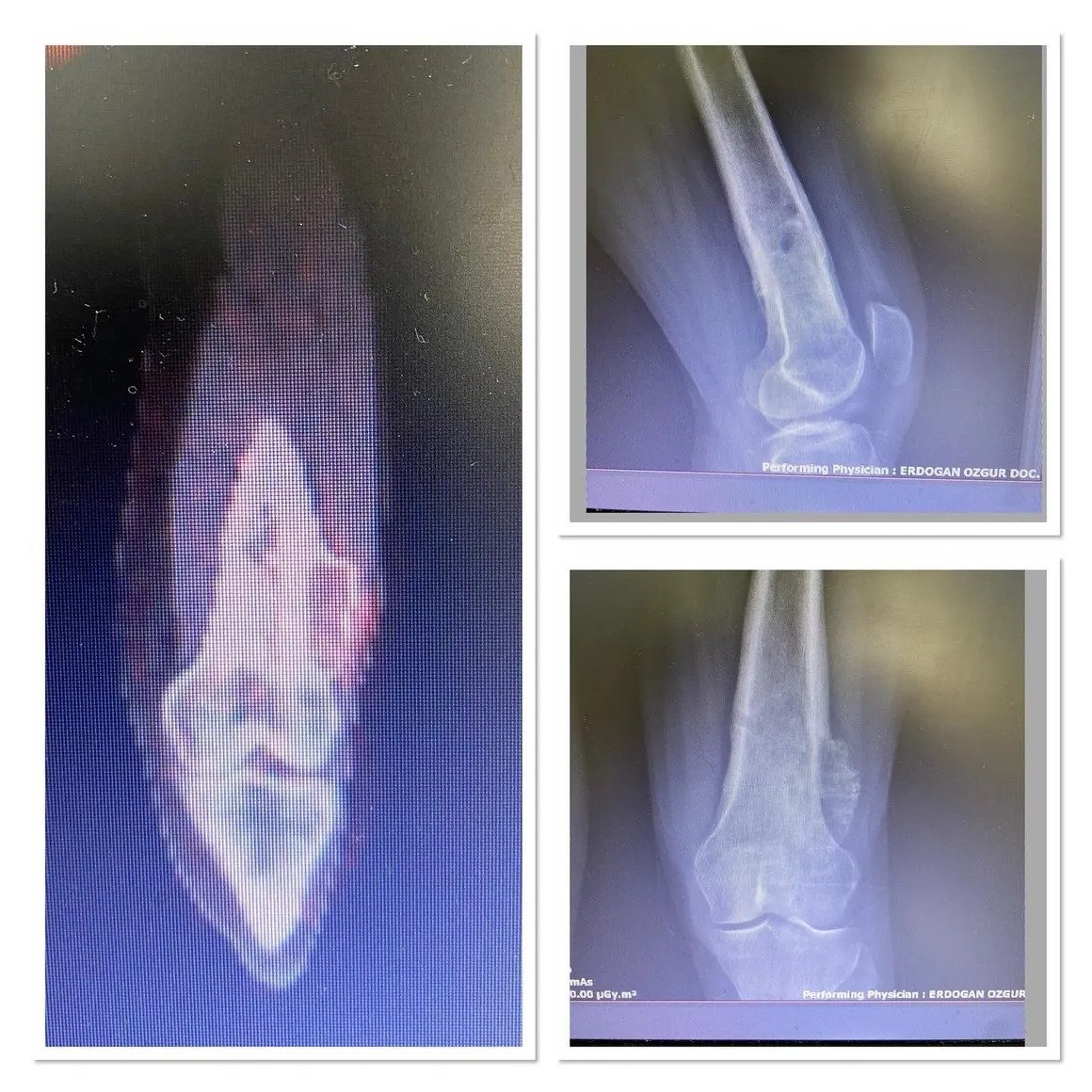
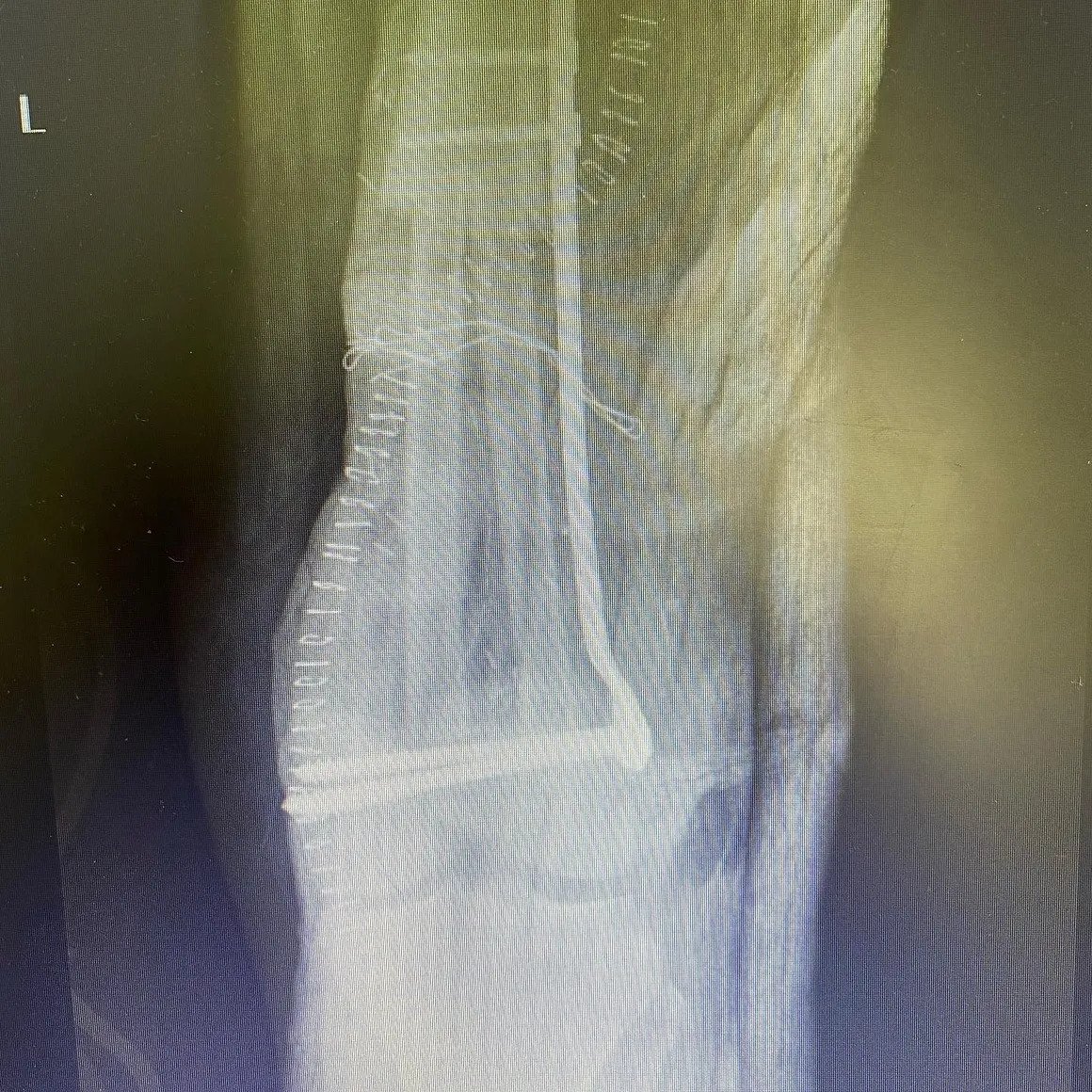
من ناحية أخرى، تسبب الأورام الخبيثة ألمًا موضعيًا وتظهر نمواً حالاً وتحللياً بحدود غير واضحة مع بقاء العظم سليماً في صور الأشعة. قد يُلاحظ تدمير الغشاء العظمي و/أو تفاعل السمحاق (الصورة 2).
في هذه المرحلة، يجب أن يحيل طبيب العظام التقليدي مريضه إلى أخصائي أورام العظام. تعد تقنيات التصوير المتقدمة والخزعة من الأساليب التي يقررها طبيب الأورام المختص.
عيادة أورام العظام
يختلف العرض السريري بشكل كبير. قد تظهر الآفات عند المرضى بالصدفة أو من خلال أعراض مثل الألم والتورم. على سبيل المثال، قد تظهر خلل التنسج الليفي أو داء الورم الغضروفي العظمي مع انحناء العظام لدى المرضى. قد تحدث كسور أو كتل في الأنسجة الرخوة أو تورمات مع الورم في العظم. تُرى الآفات المؤلمة عادةً في الأورام العدوانية (حميدة ولكن عدوانية) أو الأورام ذات الإمكانية الخبيثة.
نظرًا لأن الطيف السريري للأورام الحميدة والخبيثة واسع جدًا، يجب أن يتم التشخيص من قبل طبيب ذو خبرة في جراحة الأورام. قد يؤدي التشخيص والعلاج غير الصحيح وغير الكافي إلى تعريض المريض الذي يمكن علاجه بالمراقبة البسيطة أو العلاج لاختبارات وعلاجات غير ضرورية ومكلفة وضارة. وبالمثل، فإن التشخيص والعلاج غير الكافي للأورام العدوانية والخبيثة قد يؤدي إلى فقدان الأطراف أو فقدان الحياة.
العيادة في الأورام الحميدة
قد يكون هناك ألم معتدل يتم تخفيفه بواسطة المسكنات. يظهر الألم ببطء وقد يكون مرتبطًا بالنشاط أو الصدمة. على سبيل المثال، الألم الليلي الذي يستجيب للمسكنات هو نموذج شائع في الورم العظمي العظماني. تُسمى الكسور التي تحدث نتيجة لحركة لا تؤدي عادةً إلى كسر العظام بالكسور المرضية. في بعض الآفات الحميدة، قد تتطور الكسور المرضية نتيجة لصدمات مفردة أو متكررة.
إذا تم اكتشاف الآفة عن طريق الصدفة أثناء عدم وجود ألم أو أعراض لدى المريض، فمن المرجح جدًا أنها غير ضارة.
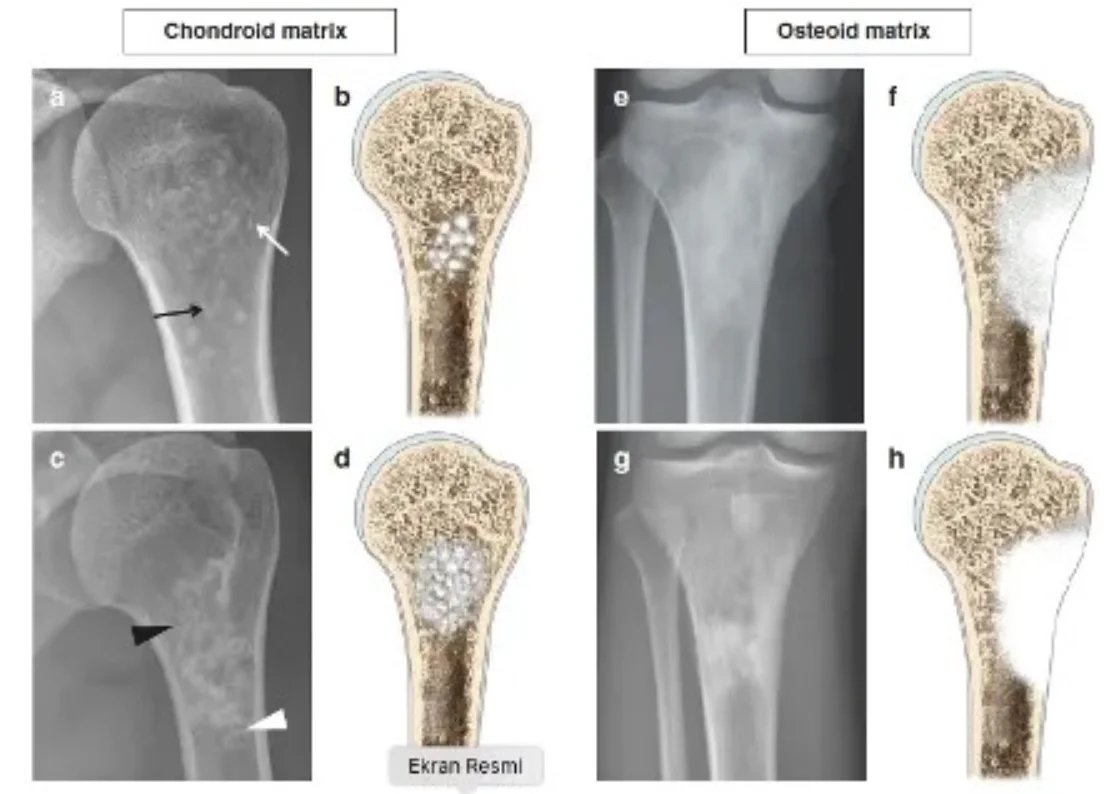
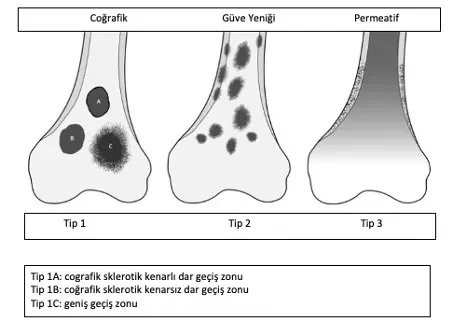
سيتمكن جراح الأورام ذو الخبرة من تحديد ما إذا كانت الآفة حميدة أو تتطلب خزعة بناءً على عمر المريض وموقع الآفة وصورة الأشعة السينية. يجب أن يشمل الفحص الإشعاعي العظم بالكامل. عادةً ما تكون الأورام الحميدة ذات طبيعة جغرافية، ولها مناطق انتقال ضيقة وحواف متصلبة (الشكل 1). قد يحدث ترقق في العظم الداخلي، لكن تدمير القشرة نادر الحدوث. من بين المعايير المفيدة الأخرى في التشخيص هو تركيب الآفة.
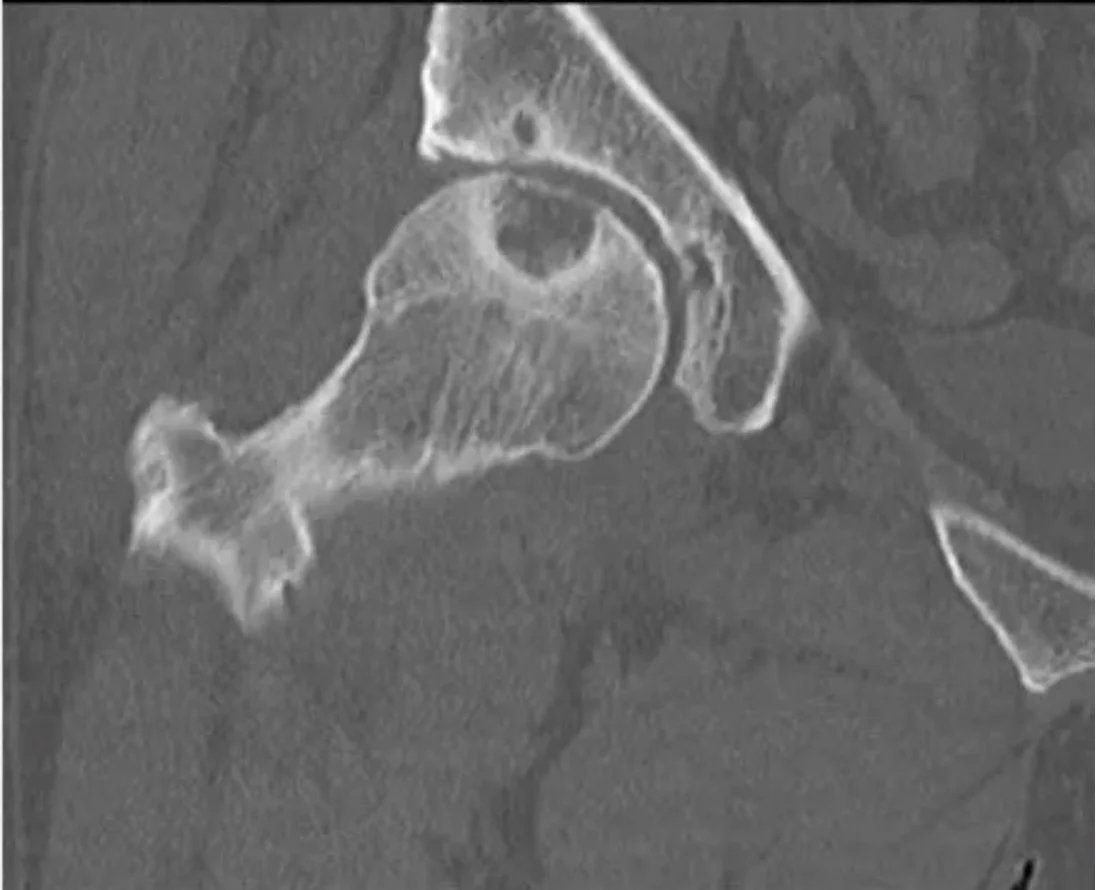
يوضح التصوير بالرنين المغناطيسي مكونات الأنسجة الرخوة، واحتباس مادة التباين، ووذمة نخاع العظم، وخصائص إشارة الآفة. يكون التصوير الومضاني فعالًا في تشخيص خلل التنسج الليفي المتعدد، داء الغضروفات المتعددة، والتهاب الخلايا النسيجية لرؤية إصابات العظام المتعددة. لا يشير التصوير الومضاني البارد إلى أن الآفة عدوانية أو غير خبيثة (مثل الورم النخاعي المتعدد أو انتقال سرطان الخلايا الكلوية). كما يتم تضمين الآفات التنكسية والناجمة عن الإفراط في الاستخدام في التشخيص التفريقي للآفات المجاورة للمفصل.
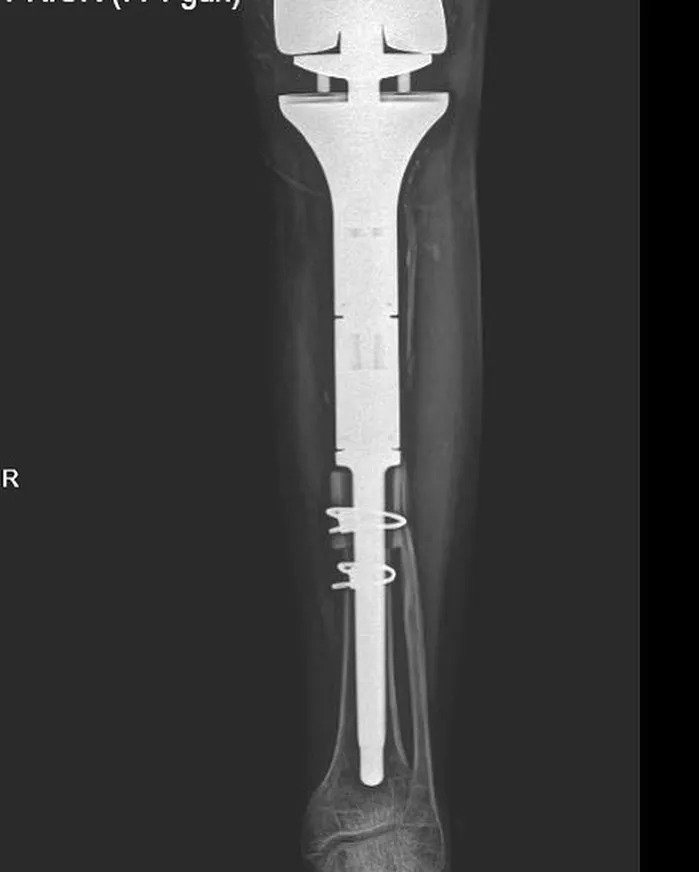
إذا كان هناك تدمير للقشرة العظمية، أو نمو منتشر، أو تفاعل سمحاقي، فإن الفحص الإضافي يكون ضروريًا. إذا لم يكن التشخيص واضحًا على الرغم من التصوير المقطعي المحوسب (CT) والتصوير بالرنين المغناطيسي (MRI)، فإن الخزعة تصبح ضرورية. بعد تأكيد تشخيص الورم العظمي الحميد، يمكن متابعة المريض بفحوصات إشعاعية على فترات تتراوح بين 3-6 أشهر لضمان استقرار الآفة. قد تكون التدخلات الجراحية ضرورية لمنع تدمير العظام، واكتشاف الكسور المرضية، أو تقوية الآفات المهددة بالانكسار، ومنع التشوهات.
العيادة في الأورام الخبيثة
يمكن أن يختلف العرض السريري بشكل كبير. قد تظهر الآفات عند المرضى بالصدفة أو مع أعراض مثل الألم والتورم. على سبيل المثال، يظهر المرضى الذين يعانون من خلل التنسج الليفي أو داء الورم الغضروفي العظمي علامات انحناء العظام. يكون الألم غالبًا شديدًا ولا تكفي المسكنات العادية. يكون الألم عميقًا ومستمراً وغير مرتبط بالنشاط أو الراحة. إذا حدث كسر مرضي، يظهر الألم فجأة.
قد يُلاحظ خدر في القدمين والساقين، وضعف، واضطرابات في وظائف الأمعاء والمثانة في حالات أورام العمود الفقري والعجز. قد يكون هناك تورم مصاحب. قد تحدث أعراض مثل الإرهاق، والضعف، والحمى. في التحاليل المخبرية، يمكن ملاحظة ارتفاع في الفوسفاتاز القلوي، وزيادة مستوى الكالسيوم، وفقر الدم. يعد التاريخ العائلي للأورام السرطانية والساركوما أمرًا مهمًا في تقييم الحالة. على سبيل المثال، متلازمات مثل الورم الأرومي الشبكي، ومتلازمة لي-فراوميني، ومتلازمة روثموند-طومسون قد تزيد من احتمالية الإصابة بأورام العظام مثل الساركوما العظمية. كما تم الإبلاغ عن إمكانية تطور آفات داء الغضروفات المتعددة نحو الأسوأ.
بالإضافة إلى ذلك، قد تتطور الساركوما لدى مرضى باجيت، والمرضى الذين لديهم تاريخ سابق من العلاج الإشعاعي، والتهاب العظم والنقي المزمن، واحتشاء العظام. يجب إجراء الخزعة بواسطة جراح أورام العظام، حيث يجب أن تتم بأقل تدخل ممكن، وهذا يتطلب خبرة كبيرة. علاوة على ذلك، يجب اختيار موقع الخزعة بحيث لا يلوث الأوعية الدموية والأعصاب المهمة. يجب أن يكون موقع الخزعة متماشياً مع الخط الجراحي المخطط له في الجراحة الفعلية للورم. خلاف ذلك، قد تتطلب الجراحة فقدانًا كبيرًا للعضلات والأنسجة، وزراعة أوعية دموية معقدة، وفقدان الأعصاب، وزراعة الجلد، مما قد يزيد من خطر فقدان الطرف ويقلل من متوسط العمر المتوقع.
إذا تم تشخيص ورم عظمي خبيث، فيجب إجراء تحديد مرحلي (staging). لهذا، يجب إجراء التصوير المقطعي بالإصدار البوزيتروني (PET) بسرعة. لدى المرضى الذين تزيد أعمارهم عن 40 عامًا، تكون الآفة عادةً ناتجة عن سرطان نقيلي، أو الورم النخاعي المتعدد، أو سرطان الغدد اللمفاوية. بالإضافة إلى ذلك، يجب تقييم الثدي لدى النساء والبروستاتا لدى الرجال، كما يجب إجراء الرحلان الكهربائي للبروتين في مصل الدم والبول. قد يتطلب العلاج نهجًا متعدد التخصصات يشمل أطباء الأورام الإشعاعية والطبية تحت إشراف جراح أورام العظام.
قد تحدث كسور، وكتل في الأنسجة الرخوة، وتورمات مع الورم في العظم. تظهر الآفات المؤلمة عادةً في الأورام العدوانية (الحميدة ولكن العدوانية) أو الأورام ذات الإمكانية الخبيثة. نظرًا لأن الطيف السريري للأورام الحميدة والخبيثة واسع جدًا، يجب أن يتم التشخيص بواسطة طبيب ذو خبرة في جراحة الأورام. قد يؤدي التشخيص والعلاج غير الصحيح وغير الكافي إلى تعريض المريض، الذي يمكن علاجه بالمراقبة البسيطة أو العلاج، لاختبارات وعلاجات غير ضرورية ومكلفة وضارة. وبالمثل، فإن التشخيص والعلاج غير الكافي للأورام العدوانية والخبيثة قد يؤدي إلى فقدان الأطراف أو فقدان الحياة.
أورام الأنسجة الرخوة
تعد أورام الأنسجة الرخوة أكثر شيوعًا من أورام العظام، وغالبًا ما تكون حميدة. تبدأ عملية التشخيص بأخذ تاريخ مرضي مفصل وفحص سريري دقيق. يتم استخدام الأشعة السينية، التصوير بالرنين المغناطيسي (MRI)، التصوير بالموجات فوق الصوتية (USG)، التصوير المقطعي المحوسب (CT)، والتصوير المقطعي بالإصدار البوزيتروني (PET) للفحوصات المتقدمة. كما تُستخدم هذه الأدوات أيضًا لتقييم استجابة العلاج.
الأورام الحميدة أكثر شيوعًا بمقدار 100 مرة مقارنة بالأورام الخبيثة. في التاريخ المرضي والفحص، تعد عوامل مثل موقع الكتلة، حجمها، وتماسكها ذات أهمية كبيرة. يتم أيضًا التحقق من عمقها بالنسبة إلى اللفافة العضلية.
أسئلة يجب طرحها:
- متى تم ملاحظة الكتلة؟
- هل هناك زيادة في الحجم؟
- ما هو معدل النمو؟
- هل هناك أي انخفاض في الحجم؟
- هل هناك كتلة مصاحبة؟
- هل هناك ألم، احمرار في الجلد، أو تورم في العقد اللمفاوية الإقليمية؟
- هل هناك حمى، قشعريرة، أو تعرق ليلي؟
بالإضافة إلى ذلك، يجب طرح أسئلة حول مواضيع مثل التعرض للصدمة، استخدام مميعات الدم، وجود تاريخ سابق للإصابة بالسرطان، والسفر الدولي.
الكتلة الصغيرة، اللينة، السطحية والمستقرة لسنوات من المرجح جدًا أن تكون حميدة.
الكتل الكبيرة، الصلبة، العميقة والمتزايدة في الحجم لديها احتمال عالٍ بأن تكون خبيثة.
قد تحدث الأورام الدموية نتيجة الصدمات الخفيفة لدى الأشخاص الذين يستخدمون مميعات الدم، لكن هذه الأورام الدموية قد تخفي وجود سرطان كامن.
يساعد وجود التكلس داخل الكتلة في التشخيص التفريقي. على سبيل المثال، في الكتلة الحميدة الناتجة عن الصدمة والمسماة "التهاب العضلات المتعظم"، يحدث التكلس في المحيط (التكلس المحيطي)، في حين أنه في الساركوما العظمية للأنسجة الرخوة (الخبيثة) يحدث التكلس في المركز. يكون التكلس أكثر عشوائية من التمعدن الطبيعي. يمكن رؤية الحصيات الوريدية في التشوهات الوعائية، كما يمكن رؤية التكلسات الضمور في بعض الأورام الدهنية. إذا بدت هذه التكلسات الضمورية عدوانية، فقد يشير التشخيص إلى الساركوما الزليلية، وهي ورم خبيث شديد. إذا كانت هناك تكلسات منتظمة متعددة حول المفصل، فيجب أن يتبادر إلى الذهن وجود ورم حميد يسمى "التكون الغضروفي الزليلي".
يشير ظهور تفاعل سمحاقي عدواني أو تدمير قشري في العظام المجاورة للكتلة على الأشعة السينية إلى احتمالية عالية بأن الكتلة خبيثة. كما أن الإشارات العالية على T2 في التصوير بالرنين المغناطيسي، وحجم الكتلة الذي يتجاوز 3 سم، ووجودها تحت اللفافة، والوذمة المحيطية، والنزيف داخل الكتلة، والتباين غير المتجانس على T1، ونخر الورم، أو غزو الورم للعظام أو الأوعية الدموية أو الأعصاب، والتعزيز المتباين المحيطي أو العقيدي أو غير المتجانس، كلها علامات على أن الكتلة على الأرجح خبيثة.
بفضل استخدام الأدوية في التصوير بالرنين المغناطيسي (التصوير بالرنين المغناطيسي مع التباين)، يمكن تحديد الأورام الدموية، والتمييز بين الكتل الكيسية والصلبة، بالإضافة إلى الكشف عن المناطق الكيسية أو النخرية داخل الكتلة، مما يساعد في اختيار الموقع الأنسب لأخذ الخزعة. ومع ذلك، يمكن لكل من الكتل الكيسية والأورام الغنية بالبنية المخاطية أن تظهر مضيئة في تسلسلات التصوير الحساسة للسوائل. لا يمكن التفريق بين هذه الكتل إلا باستخدام التصوير بالرنين المغناطيسي مع التباين. في الكتل الكيسية، يتم احتباس المادة الدوائية محيطيًا، بينما في الكتل الصلبة تحتفظ بالمادة المتباينة بشكل صلب.
إذا تم إجراء العلاج الإشعاعي و/أو العلاج الكيميائي قبل الجراحة، فمن الضروري فحص الورم من خلال تصوير جديد بالرنين المغناطيسي قبل العملية. بهذه الطريقة، يمكن تقييم استجابة العلاج. في بعض الأحيان، على الرغم من هذه العلاجات، قد تستمر الكتلة في النمو، وأحد أسباب ذلك هو أن الكتلة تبدأ في التلاشي والنزيف من الداخل، وهو ما يمكن كشفه من خلال التصوير بالرنين المغناطيسي مع التباين.
الساركوما
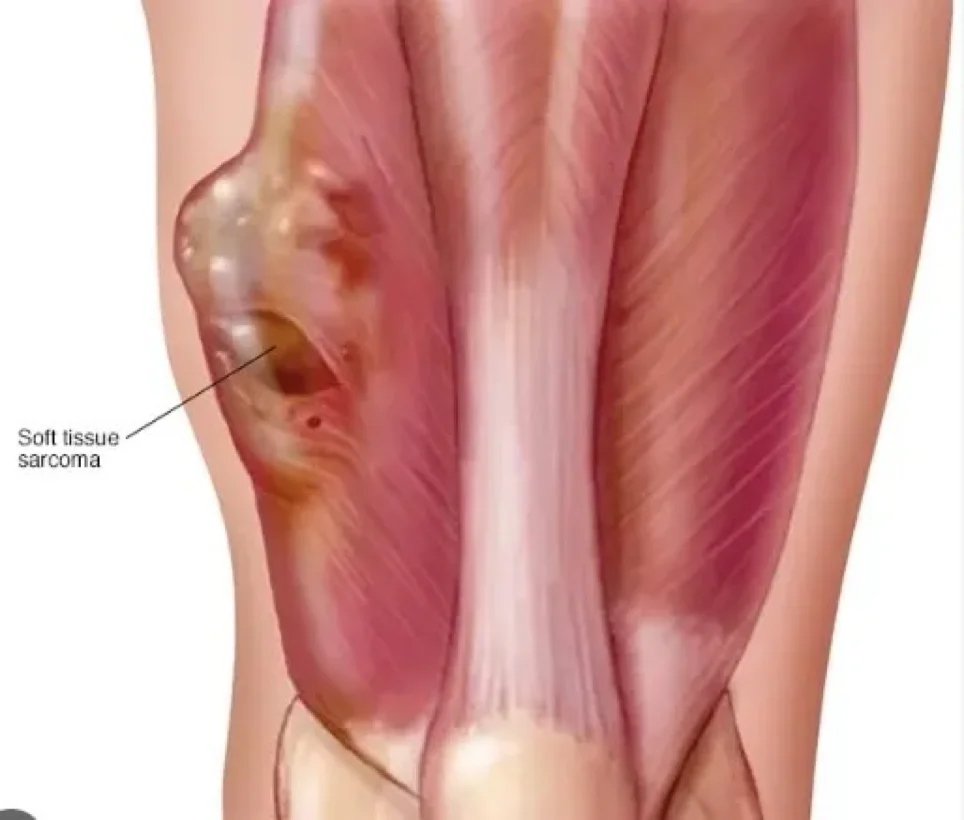
الساركوما هي ورم خبيث، وهو نوع من السرطان ينشأ من خلايا متحولة ذات أصل ميزانشيمي (نسيج ضام). يشمل مصطلح النسيج الضام العظام، الغضاريف، الدهون، الأنسجة الوعائية أو الأنسجة المكونة للدم، ويمكن أن تتطور الساركوما في أي من هذه الأنسجة.
نتيجة لذلك، هناك العديد من الأنواع الفرعية للساركوما، ويتم تصنيفها وفقًا لنوع النسيج والخلية التي نشأ منها الورم. تعتبر الساركوما أورامًا أولية في الأنسجة الضامة، مما يعني أنها تنشأ مباشرة من هذه الأنسجة.
على عكس الأورام الثانوية (أو "النقيلية") في الأنسجة الضامة، والتي تحدث عندما ينتشر السرطان من مكان آخر في الجسم (مثل الرئتين، نسيج الثدي، أو البروستاتا) إلى الأنسجة الضامة. يعود أصل كلمة "ساركوما" إلى الكلمة اليونانية σάρκωμα (sarōma) والتي تعني "نسيج لحمي أو مادة"، والمشتقة من الكلمة اليونانية σάρξ (sarx) التي تعني "اللحم".
التصنيف
يتم تقسيم الساركوما عادةً إلى مجموعتين رئيسيتين: ساركوما العظام وساركوما الأنسجة الرخوة، ولكل منهما أنواع فرعية متعددة. في الولايات المتحدة، تصدر اللجنة الأمريكية المشتركة للسرطان (AJCC) إرشادات تصنف أنواع الساركوما الفرعية.
تشمل هذه الأنواع الفرعية ما يلي:
الأنواع الفرعية لساركوما العظام:
- الساركوما العظمية (Osteosarcoma) والساركوما الغضروفية (Chondrosarcoma)
- أورام الخلايا المستديرة/المغزلية ضعيفة التمايز (بما في ذلك ساركوما إيوينغ) والساركوما الوعائية البطانية الدموية (Hemangioendothelioma)
- الساركوما الوعائية (Angiosarcoma)
- الساركوما الليفية/الساركوما الليفية العضلية (Fibrosarcoma/Myofibrosarcoma) والورم الحبلاني (Chordoma)
- الأدامانتينوما (Adamantinoma)
أخرى:
- الساركوما الشحمية / الساركوما العضلية الملساء
- ورم غمد العصب المحيطي الخبيث
- الساركوما العضلية المخططة
- الساركوما الزليلية
- ورم ليفي مفرد خبيث
الأنواع الفرعية لساركوما الأنسجة الرخوة:
- الساركوما الشحمية (تشمل الأنواع التالية: الورم الشحمي غير النمطي/الساركوما الشحمية متمايزة جيدًا، الساركوما الشحمية غير المتمايزة، الساركوما الشحمية المخاطية، الساركوما الشحمية متعددة الأشكال، والساركوما الشحمية المخاطية متعددة الأشكال)
- الورم الليفي الجلدي البارز (يشمل الأنواع المصطبغة)
- الورم الليفي الجلدي البارز، الأورام الليفية الساركوماوية
- الورم الليفي العملاق
- الورم الليفي المفرد الخبيث
- الورم العضلي الليفي الالتهابي
- الساركوما العضلية الليفية منخفضة الدرجة
- الساركوما الليفية (تشمل الأنواع البالغة والمتصلبة الظهارية)
- الساركوما الليفية المخاطية (المعروفة سابقًا بالورم الليفي الهيستوسيتي الخبيث المخاطي)
- الساركوما الليفية المخاطية منخفضة الدرجة
- ورم الخلايا العملاقة في الأنسجة الرخوة (الساركوما العضلية الملساء)
- الورم الكبي الخبيث
- الساركوما العضلية المخططة (تشمل: الجنينية، السنخية، متعددة الأشكال، والمغزلية/المتصلبة)
- ورم بطاني وعائي (يشمل: الشكل الشبكي، الكاذب العضلي، والظهاري)
- الساركوما الوعائية للأنسجة الرخوة
- الساركوما العظمية خارج الهيكل العظمي
- ورم الجهاز الهضمي السدوي الخبيث (GIST)
- ورم غمد العصب المحيطي الخبيث (يشمل النوع الظهاري)
- ورم تريتون الخبيث
- ورم الخلايا الحبيبية الخبيث
- الورم الليفي المخاطي العظمي الخبيث المتعظم
- الساركوما السدوية غير المصنفة
- سرطان الظهارة العضلي
- ورم النسيج المتوسط الفسفاتي الخبيث
- الساركوما الزليلية (تشمل: الخلايا المغزلية، ثنائية الطور، وغير المصنفة)
- الساركوما الظهارية
- الساركوما السنخية اللينة
- الساركوما الصافية الخلايا في الأنسجة الرخوة
- الساركوما الغضروفية المخاطية خارج الهيكل العظمي
- ساركوما إيوينغ خارج الهيكل العظمي
- ساركوما الخلايا التغصنية المتداخلة
- ورم الخلايا المستديرة الصغير المشوه
- الورم الرابدويدي خارج الكلى
- ورم الخلايا الظهارية حول الأوعية الدموية غير المصنف
- الساركوما الغشائية الداخلية
- الساركوما المغزلية غير المتمايزة
- الساركوما متعددة الأشكال غير المتمايزة
- الساركوما المستديرة غير المتمايزة
- الساركوما الظهارية غير المتمايزة
- الساركوما غير المتمايزة غير المصنفة
أعراض الساركوما:
تشمل أعراض ساركوما العظام عادةً آلام العظام، خاصة أثناء الليل، بالإضافة إلى التورم حول موقع الورم.
تختلف أعراض ساركوما الأنسجة الرخوة، لكنها عادةً ما تظهر على شكل كتل أو عقيدات صلبة وغير مؤلمة. أما أورام الجهاز الهضمي السدوية (وهي نوع فرعي من ساركوما الأنسجة الرخوة)، فهي غالبًا غير مصحوبة بأعراض، ولكنها قد ترتبط بشكاوى غامضة مثل آلام البطن، الشعور بالامتلاء، أو علامات أخرى تدل على انسداد معوي.
الأسباب وعوامل الخطر:
لا يزال السبب الدقيق لمعظم حالات ساركوما العظام غير معروف، ولكن هناك عدة عوامل مرتبطة بزيادة خطر الإصابة بها. يعد التعرض السابق للإشعاع المؤين (مثل العلاج الإشعاعي السابق) أحد عوامل الخطر المعروفة. كما أن التعرض للعوامل المؤلكلة، الموجودة في بعض أدوية العلاج الكيميائي للسرطان، يزيد أيضًا من خطر الإصابة بساركوما العظام. بعض المتلازمات الوراثية، مثل متلازمة لي-فراوميني، والطفرات الوراثية في جين RB1، ومرض باجيت للعظام، ترتبط بزيادة خطر الإصابة بساركوما العظام.
تحدث معظم حالات ساركوما الأنسجة الرخوة بسبب طفرات جينية يصفها الأطباء بأنها "عشوائية" أو "متفرقة" داخل خلايا الشخص المصاب. ومع ذلك، هناك بعض عوامل الخطر المرتبطة بزيادة خطر الإصابة بساركوما الأنسجة الرخوة. يُعد التعرض السابق للإشعاع المؤين أحد عوامل الخطر المعروفة. كما أن التعرض لكلوريد الفينيل (مثل الأبخرة المتولدة أثناء إنتاج كلوريد البوليفينيل (PVC))، والزرنيخ، ومادة Thorotrast مرتبط بزيادة خطر الإصابة بالساركوما الوعائية.
يُعد الوذمة اللمفية، مثل تلك التي تنتج عن بعض علاجات سرطان الثدي، أيضًا عامل خطر للإصابة بالساركوما الوعائية. وكما هو الحال مع ساركوما العظام، فإن بعض المتلازمات الوراثية، مثل متلازمة لي-فراوميني، وداء السلائل الغدي العائلي، والورام الليفي العصبي من النوع 1، والطفرات الوراثية في جين RB1، ترتبط بزيادة خطر الإصابة بساركوما الأنسجة الرخوة. أما ساركوما كابوزي، فهي ناتجة عن فيروس الهربس المرتبط بساركوما كابوزي (HHV-8).
الآليات:
على الرغم من أن التغيرات الجزيئية الدقيقة التي تؤدي إلى الساركوما ليست معروفة دائمًا، فإن بعض أنواع الساركوما ترتبط بطفرات جينية محددة.
أمثلة على ذلك:
ترتبط معظم حالات ساركوما إيوينغ بعملية انتقال كروموسومي، حيث ينضم جزء من الكروموسوم 11 إلى جزء من الكروموسوم 22. يؤدي ذلك إلى اندماج جين EWS مع جينات أخرى، بما في ذلك جين FLI1 في 90% من حالات ساركوما إيوينغ، ومع جين ERG في 5-10% من الحالات. تؤدي هذه الاندماجات إلى إنتاج بروتينات غير طبيعية، ولكن لا يُعرف بالضبط كيف تؤدي هذه البروتينات إلى السرطان.
يرتبط الورم الليفي الجلدي البارز غالبًا بانتقال كروموسومي، حيث يندمج جين COL1A1 مع جين PDGFRB. يؤدي ذلك إلى تنشيط مفرط لإشارات PDGF، والتي يُعتقد أنها تعزز انقسام الخلايا، مما يؤدي في النهاية إلى تطور الورم.
يرتبط الورم العضلي الليفي الالتهابي غالبًا بإعادة ترتيب جين ALK، وأحيانًا بإعادة ترتيب جين HMGA2.
يرتبط ورم الخلايا العملاقة في الأنسجة الرخوة غالبًا بانتقال كروموسومي بين الكروموسوم 1 والكروموسوم 2، حيث يندمج جين CSF1 مع جين COL6A3. يؤدي ذلك إلى زيادة إنتاج بروتين CSF1، والذي يُعتقد أنه يلعب دورًا في تطور السرطان.
ترتبط العديد من حالات الساركوما الشحمية بتكرار جزء من الكروموسوم 12، مما يؤدي إلى نسخ إضافية من الجينات المعروفة بتعزيز السرطان ("الأونكوجينات")، مثل جين CDK4، وجين MDM2، وجين HMGA2.
التشخيص:
ساركوما العظام
يبدأ تشخيص ساركوما العظام بأخذ تاريخ طبي مفصل وإجراء فحص سريري، والذي قد يكشف عن علامات وأعراض مميزة (انظر القسم أعلاه حول العلامات والأعراض). على الرغم من أن بعض أنواع ساركوما العظام (مثل الساركوما العظمية) قد ترتبط بارتفاع مستويات الفوسفاتاز القلوي، وأخرى (مثل ساركوما إيوينغ) بارتفاع معدل ترسيب كريات الدم الحمراء، إلا أن الفحوصات المخبرية ليست مفيدة بشكل خاص في التشخيص.
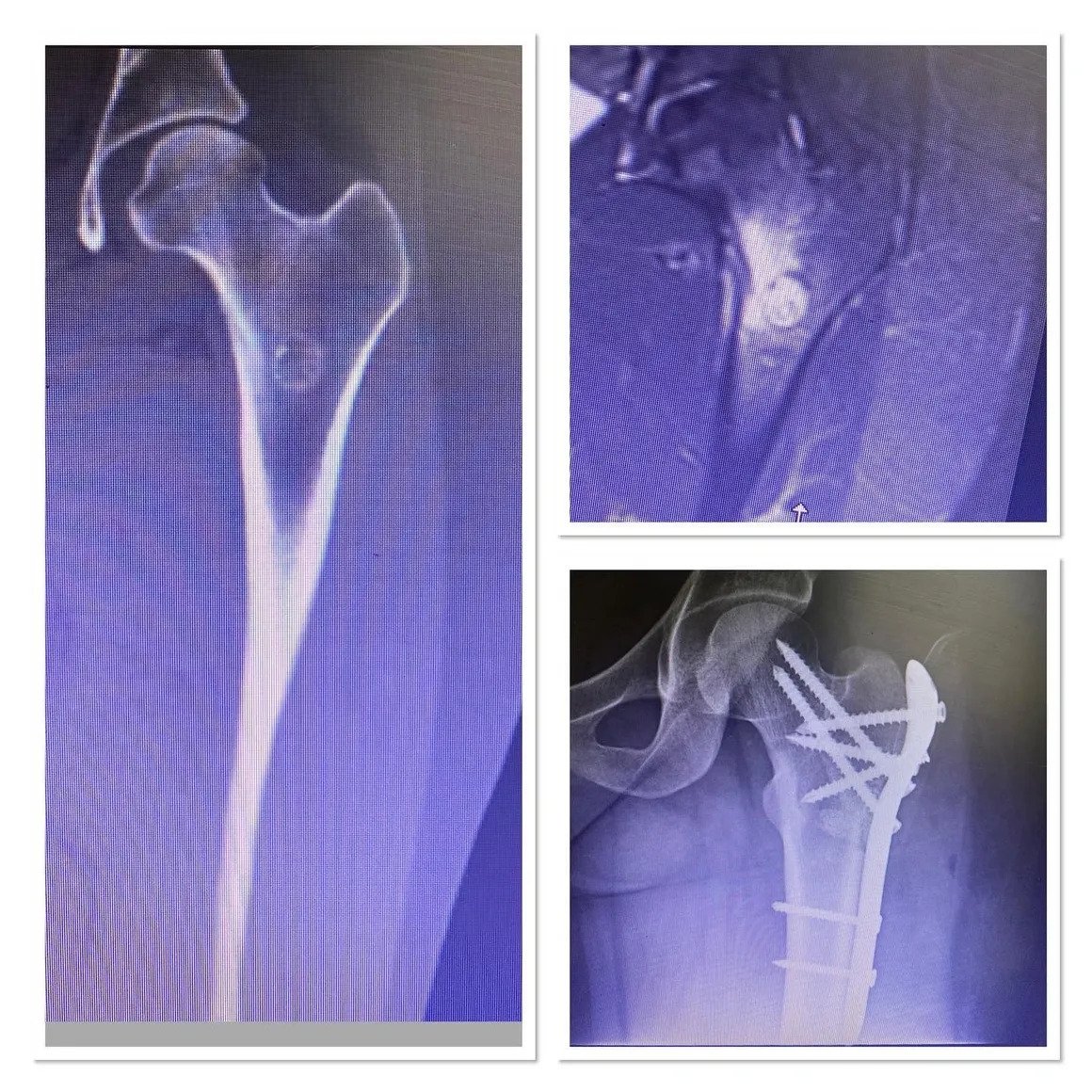
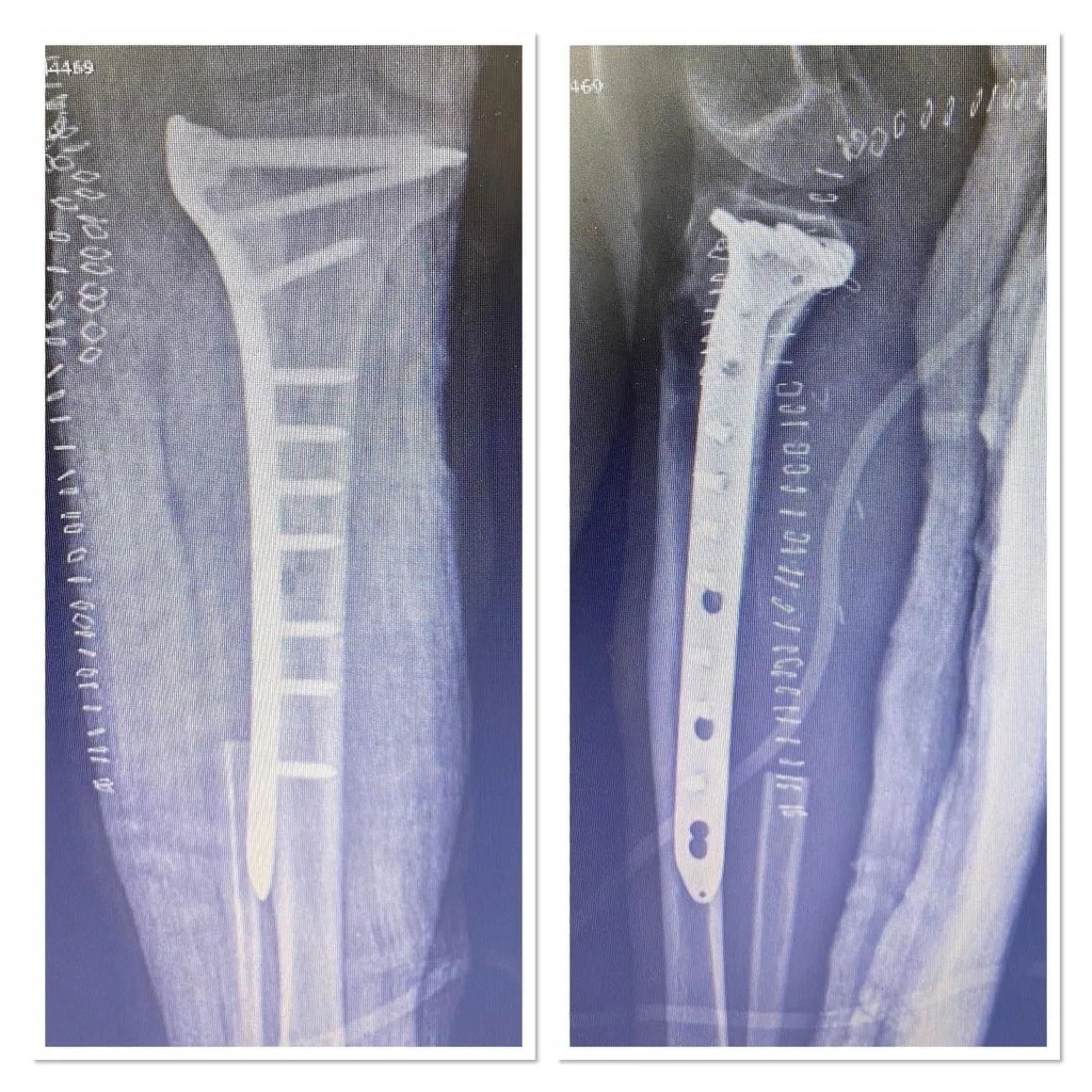
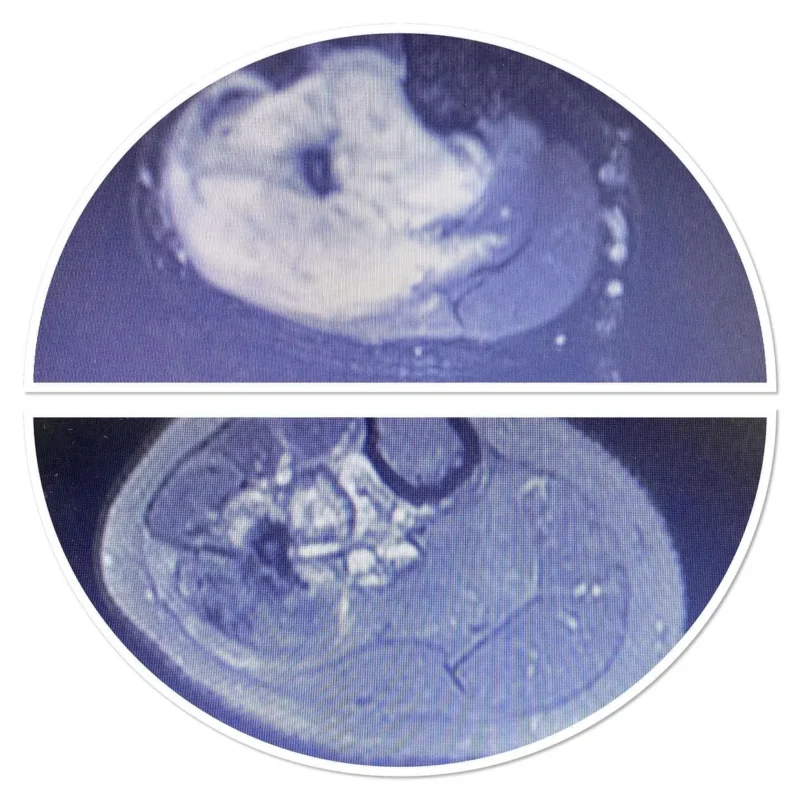
من المهم ملاحظة أن أياً من هذه النتائج المخبرية ليست خاصة بساركوما العظام؛ مما يعني أن ارتفاع هذه القيم قد يكون مرتبطًا بالعديد من الحالات الأخرى إلى جانب الساركوما، وبالتالي لا يمكن الاعتماد عليها بشكل قاطع لتشخيص الساركوما. تعتبر دراسات التصوير أمرًا بالغ الأهمية في التشخيص، حيث يبدأ معظم الأطباء بطلب صورة الأشعة السينية العادية. تشمل دراسات التصوير الأخرى المستخدمة في التشخيص التصوير بالرنين المغناطيسي (MRI) ومسح العظام بالنظائر المشعة. على الرغم من أن التصوير المقطعي المحوسب (CT) يُعد أداة مهمة في تحديد مرحلة المرض، إلا أنه لا يُستخدم عادةً في تشخيص معظم أنواع ساركوما العظام. يتطلب التشخيص النهائي إجراء خزعة من الورم وفحص عينة الخزعة بعناية من قبل أخصائي علم الأمراض المتمرس.
ساركوما الأنسجة الرخوة
يبدأ تشخيص ساركوما الأنسجة الرخوة بأخذ تاريخ طبي شامل وإجراء فحص سريري دقيق. قد تشمل دراسات التصوير كلًا من التصوير المقطعي المحوسب (CT) أو التصوير بالرنين المغناطيسي (MRI)، لكن التصوير المقطعي المحوسب يكون مفضلًا في حالات ساركوما الأنسجة الرخوة الموجودة في الصدر أو البطن أو خلف الصفاق. يمكن أن يكون التصوير المقطعي بالإصدار البوزيتروني (PET) مفيدًا أيضًا في التشخيص، لكنه يُستخدم بشكل شائع في تحديد مرحلة المرض. وكما هو الحال في ساركوما العظام، يتطلب التشخيص النهائي إجراء خزعة وتقييم العينة نسيجيًا من قبل أخصائي علم الأمراض المدرب.
تحديد المرحلة:
يشير تحديد مرحلة السرطان عمومًا إلى مدى تقدم المرض، وغالبًا ما يعتمد على عوامل مثل حجم الورم وما إذا كان قد انتشر إلى أجزاء أخرى من الجسم. يعد تحديد المرحلة أمرًا مهمًا لأن المرحلة تؤثر على التكهن (النتيجة المتوقعة)، وكذلك على أنواع العلاجات التي من المرجح أن تكون فعالة ضد السرطان. في تحديد مراحل الساركوما، يتم فحص ما إذا كان الورم قد نما إلى الأنسجة المحيطة (الغزو الموضعي)، أو انتشر إلى العقد الليمفاوية (النقائل العقدية)، أو غزا أنسجة أو أعضاء أخرى في الجسم (النقائل البعيدة).
أكثر أدوات التصوير شيوعًا المستخدمة في تحديد مراحل ساركوما العظام هي التصوير بالرنين المغناطيسي (MRI) أو التصوير المقطعي المحوسب (CT) لتقييم الورم الأساسي، والتصوير المقطعي المحوسب المحسّن بالتباين للصدر لتقييم ما إذا كان السرطان قد انتشر (أي انتقل) إلى الرئتين، ومسح العظام بالنظائر المشعة لتقييم النقائل العظمية. يشمل تحديد مراحل ساركوما الأنسجة الرخوة عادةً تصوير الورم الأساسي باستخدام التصوير بالرنين المغناطيسي (MRI) أو التصوير المقطعي المحوسب (CT) لتحديد حجم الورم، بالإضافة إلى التصوير المقطعي المحوسب للصدر المحسّن بالتباين لتقييم الأورام المنتشرة في الرئتين.
التصنيف حسب الدرجة:
مثل بعض أنواع السرطان الأخرى، يتم تصنيف الساركوما إلى درجات (منخفضة، متوسطة، أو عالية) بناءً على مظهر الخلايا السرطانية تحت المجهر. يشير التصنيف العام إلى مدى عدوانية السرطان ومدى احتمالية انتشاره ("الانتقال") إلى أجزاء أخرى من الجسم.
تتمتع الساركوما منخفضة الدرجة بتكهن أفضل مقارنةً بالساركوما عالية الدرجة وعادةً ما يتم علاجها جراحيًا. أما الساركوما متوسطة وعالية الدرجة، فيتم علاجها غالبًا بمزيج من الجراحة، والعلاج الكيميائي، أو العلاج الإشعاعي. نظرًا لأن الأورام ذات الدرجات الأعلى أكثر عرضة للانتشار (غزو المناطق الإقليمية والبعيدة)، فإنها تُعالج بشكل أكثر عدوانية. أدى اكتشاف أن العديد من أنواع الساركوما حساسة للعلاج الكيميائي إلى تحسين معدلات البقاء على قيد الحياة بشكل كبير لدى المرضى. على سبيل المثال، في الحقبة التي سبقت العلاج الكيميائي، كانت نسبة البقاء على قيد الحياة على المدى الطويل لدى الأطفال المصابين بساركوما العظام الموضعية لا تتجاوز 20%، لكنها ارتفعت الآن إلى 60-70%.
العلاج
العلاج الأكثر شيوعًا لمعظم حالات الساركوما التي لم تنتشر إلى أجزاء أخرى من الجسم هو الجراحة. في الوقت الحالي، نقوم بإجراء جراحة المحافظة على الأطراف بدلاً من البتر، مما يسمح بإنقاذ أطراف المرضى في ما لا يقل عن 90% من حالات الساركوما التي تصيب الأطراف (الذراع أو الساق).
قد تُستخدم علاجات إضافية، بما في ذلك العلاج الكيميائي، العلاج الإشعاعي (المعروف أيضًا باسم "العلاج بالأشعة")، وعلاج البروتون، إما قبل الجراحة (ويسمى "العلاج الكيميائي أو الإشعاعي المساعد الجديد") أو بعد الجراحة (ويسمى "العلاج الكيميائي أو الإشعاعي المساعد"). لقد أدى استخدام العلاج الكيميائي أو الإشعاعي المساعد أو المساعد الجديد إلى تحسين التكهن بشكل كبير لدى العديد من مرضى الساركوما.
يمكن أن يكون العلاج عملية طويلة وشاقة، حيث يستغرق الأمر حوالي عام لدى العديد من المرضى.
التكهن
العوامل المؤثرة على التكهن
حددت اللجنة الأمريكية المشتركة للسرطان (AJCC) عدة عوامل تؤثر على تكهن ساركوما العظام:
حجم الورم: تميل الأورام الأكبر حجمًا إلى أن يكون لديها تكهن أسوأ مقارنة بالأورام الأصغر.
انتشار الورم إلى الأنسجة المحيطة: تميل الأورام التي انتشرت محليًا إلى الأنسجة المجاورة إلى أن يكون لديها تكهن أسوأ من الأورام التي لم تنتشر خارج موقعها الأصلي.
المرحلة ووجود النقائل: الأورام التي انتشرت ("انتقلت") إلى العقد الليمفاوية (وهو أمر نادر في ساركوما العظام) أو إلى أعضاء أو أنسجة أخرى (مثل الرئتين) يكون لديها تكهن أسوأ مقارنة بالأورام التي لم تنتشر.
درجة الورم: تميل الأورام عالية الدرجة (الدرجات 2 و3) إلى أن يكون لديها تكهن أسوأ من الأورام منخفضة الدرجة (الدرجة 1).
موقع الورم في الهيكل العظمي: تميل الأورام التي تنشأ من العمود الفقري أو عظام الحوض إلى أن يكون لديها تكهن أسوأ مقارنة بالأورام التي تنشأ من عظام الذراعين أو الساقين.
العوامل المؤثرة على التكهن في ساركوما الأنسجة الرخوة (باستثناء GIST) تشمل:
الدرجة: توصي اللجنة الأمريكية المشتركة للسرطان (AJCC) باستخدام نظام تصنيف يُعرف باسم تصنيف المجموعة الفرنسية لمراكز السرطان لساركوما الأنسجة الرخوة (FNCLCC)، حيث تكون الأورام عالية الدرجة ذات تكهن أسوأ مقارنة بالأورام منخفضة الدرجة.
العامل الرئيسي المؤثر على التكهن في أورام الجهاز الهضمي السدوية (GIST):
معدل الانقسام: يشير معدل الانقسام إلى نسبة الخلايا التي تنقسم بنشاط داخل الورم؛ حيث تكون الأورام السدوية ذات معدل انقسام مرتفع ذات تكهن أسوأ مقارنة بالأورام السدوية ذات معدل انقسام منخفض.
بيانات النتائج
وفقًا للبيانات التي نشرها المعهد الوطني للسرطان في الولايات المتحدة (NCI)، فإن معدل البقاء على قيد الحياة لمدة 5 سنوات في ساركوما العظام يبلغ 66.9%. تقدر الجمعية الأمريكية للسرطان (ACS) أن 1,660 شخصًا في الولايات المتحدة سيتوفون بسبب ساركوما العظام في عام 2019، وهو ما يمثل 0.3% من جميع وفيات السرطان. يبلغ متوسط عمر الوفاة 61 عامًا، ولكن يمكن أن تحدث الوفاة في أي فئة عمرية.
وبالتالي، فإن 12.3% من وفيات ساركوما العظام تحدث في الأشخاص الذين تقل أعمارهم عن 20 عامًا، و13.8% في الأشخاص الذين تتراوح أعمارهم بين 20-34 عامًا، و5.5% في الأشخاص الذين تتراوح أعمارهم بين 35-44 عامًا، و9.3% في الأشخاص الذين تتراوح أعمارهم بين 45-54 عامًا، و13.5% في الأشخاص الذين تتراوح أعمارهم بين 55-64 عامًا، و16.2% في الأشخاص الذين تتراوح أعمارهم بين 65-74 عامًا، و16.4% في الأشخاص الذين تتراوح أعمارهم بين 75-84 عامًا، و13.1% في الأشخاص الذين تزيد أعمارهم عن 85 عامًا.
يبلغ معدل البقاء على قيد الحياة لمدة 5 سنوات في ساركوما الأنسجة الرخوة (بغض النظر عن المرحلة) 64.5%، لكن البقاء على قيد الحياة يتأثر بعوامل عديدة، بما في ذلك المرحلة. لذلك، يبلغ معدل البقاء على قيد الحياة لمدة 5 سنوات حوالي 80.8% في حالات ساركوما الأنسجة الرخوة التي لم تنتشر خارج الورم الأساسي ("الأورام الموضعية")، و58.0% في حالات ساركوما الأنسجة الرخوة التي انتشرت فقط إلى العقد الليمفاوية القريبة، و16.4% في حالات ساركوما الأنسجة الرخوة التي انتشرت إلى أعضاء بعيدة. تقدر الجمعية الأمريكية للسرطان (ACS) أن 5,270 شخصًا سيتوفون بسبب ساركوما الأنسجة الرخوة في عام 2019، وهو ما يمثل 0.9% من جميع وفيات السرطان.
علم الأوبئة
الساركوما من الأورام النادرة جدًا. خطر تشخيص شخص سليم سابقًا بسرطان العظام الجديد أقل من 0.001% (1 من 100,000)، بينما يتراوح خطر تشخيص ساركوما الأنسجة الرخوة الجديدة بين 0.0014% و 0.005%. تقدر الجمعية الأمريكية للسرطان أنه سيكون هناك 3,500 حالة جديدة من ساركوما العظام و 12,750 حالة جديدة من ساركوما الأنسجة الرخوة في الولايات المتحدة في عام 2019.
بالنظر إلى أن العدد الإجمالي المقدر لحالات السرطان الجديدة (بجميع أنواعه) هو 1,762,450، فإن هذا يشير إلى أن ساركوما العظام تمثل فقط 0.2% من جميع حالات السرطان الجديدة (مما يجعلها النوع الثلاثين الأكثر شيوعًا من السرطان). بينما تمثل ساركوما الأنسجة الرخوة فقط 0.7% من جميع حالات السرطان الجديدة في الولايات المتحدة في عام 2019 (مما يجعلها النوع الثاني والعشرين الأكثر شيوعًا من السرطان).
تصيب الساركوما الأشخاص من جميع الأعمار. يتم تشخيص حوالي 50% من حالات ساركوما العظام و20% من حالات ساركوما الأنسجة الرخوة لدى أشخاص تقل أعمارهم عن 35 عامًا. بعض أنواع الساركوما، مثل الساركوما العضلية الملساء، والساركوما الغضروفية، وأورام الجهاز الهضمي السدوية (GIST)، أكثر شيوعًا لدى البالغين مقارنةً بالأطفال. في المقابل، فإن معظم أنواع ساركوما العظام عالية الدرجة، بما في ذلك ساركوما إيوينغ والساركوما العظمية، تكون أكثر شيوعًا لدى الأطفال والشباب.
العلاج:
غالبًا ما يتطلب علاج الساركوما العلاج الكيميائي، خاصة عندما تكون الساركوما قد انتشرت أو "انتقلت"، لكن الأدوية الكيميائية الحالية ترتبط بسمّية كبيرة ولا تكون فعالة تمامًا في قتل الخلايا السرطانية. لذلك، يجري البحث عن أدوية جديدة لعلاج الساركوما اعتبارًا من عام 2019. أحد الخيارات المحتملة هو استخدام العلاج المناعي للسرطان (مثل مثبطات نقاط التفتيش المناعية مثل مضادات PD1، مضادات PDL1، ومضادات CTLA4) لعلاج الساركوما. لم يصبح هذا العلاج أداة علاجية معتمدة بعد.
يتم أيضًا دراسة استراتيجيات أخرى مثل العلاج الجزيئي الموجه، العوامل البيولوجية (مثل جزيئات الحمض النووي الريبوزي المتداخل الصغير - siRNA)، والعلاج باستخدام الجسيمات النانوية.
أظهر الدكتور سامير راستوجي وزملاؤه استجابات طويلة الأمد للعلاج المناعي في عدة أنواع من الساركوما، مثل الساركوما متعددة الأشكال غير المتمايزة (UPS) والساركوما السنخية (ASPS).
يستمر البحث لفهم العوامل الجينية والجزيئية المحددة التي تؤدي إلى تطور الساركوما. يمكن أن يسمح ذلك بتصميم علاجات مستهدفة جديدة وتمكين الأطباء من التنبؤ بشكل أكثر دقة بتكهن المريض.
يوفر وجود مستقبل H3-B3 المناعي التنظيمي على الخلايا الورمية فرصة لاختبار العلاجات الجديدة والعوامل المستهدفة والعلاجات المناعية قيد التطوير في التجارب السريرية.
التوعية:
في الولايات المتحدة، يُعترف بشهر يوليو على نطاق واسع باعتباره شهر التوعية بالساركوما. أما في المملكة المتحدة، فيتم الاحتفال بأسبوع التوعية بالساركوما خلال شهر يوليو، بقيادة منظمة ساركوما المملكة المتحدة، وهي مؤسسة خيرية لمكافحة سرطان العظام والأنسجة الرخوة.
تم تشخيص اليوتيوبر الأمريكي تكنوبلايد بالساركوما في أغسطس 2021، وتوفي بسبب المرض في يونيو 2022 بعد أن انتشر السرطان في جسده. جمع أكثر من 500,000 دولار في حملة خيرية. قام العديد من اليوتيوبرز برفع مستوى الوعي والتبرع للمؤسسات الخيرية مثل مؤسسة الساركوما الأمريكية بعد تشخيصه ووفاته.
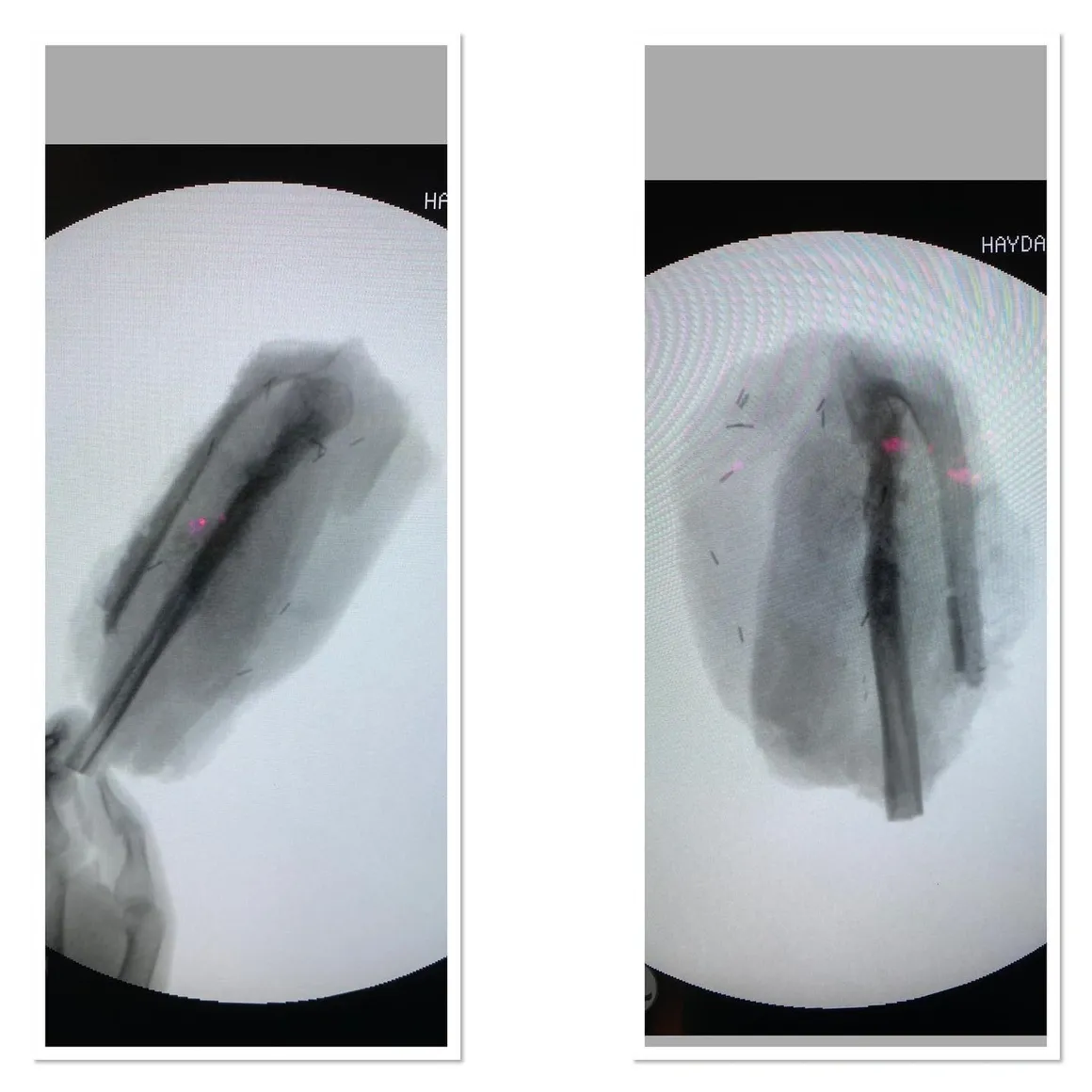
الخزعة
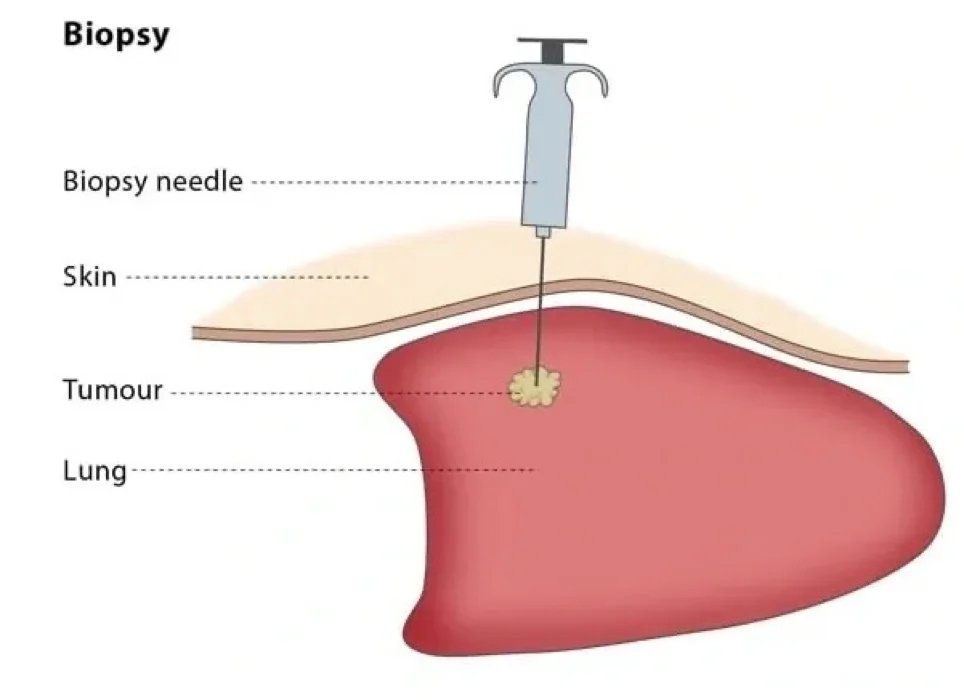
إحدى أهم المراحل في تشخيص وعلاج أورام الجهاز العضلي الهيكلي هي الخزعة. ستساعد الخزعة المخطط لها والمنفذة جيدًا في تقليل الإصابات التي قد تحدث بسبب المرض. هناك اعتقاد شائع بين الناس بأن الورم لا يجب أن يتعرض للجراحة، وفي الواقع، أعتقد أن هذا صحيح إلى حد ما. لهذا السبب، نادرًا ما نقوم بإجراء الخزعات المفتوحة.
في السنوات الأخيرة، عند تقييم العينات الصغيرة المأخوذة دون فتح الورم باستخدام إبر خاصة بالتعاون مع أخصائيي علم الأمراض ذوي الخبرة، بدأنا في تحقيق معدلات تشخيص عالية الدقة. نظرًا لأننا نقوم بأخذ الخزعات بطريقة مغلقة باستخدام الإبرة، فإن انتشار الخلايا السرطانية يكون في حده الأدنى.
المبدأ الأساسي في جراحة الأورام هو إزالة الكتلة دون رؤية الورم أو الدخول إليه، مع ترك بعض الأنسجة السليمة حوله. بمعنى آخر، لا ينبغي فعليًا "طعن" الورم أثناء العملية.
مبادئ الخزعة:
- لا يمكن إجراء جراحة السرطان دون تشخيص مؤكد للسرطان.
- يجب أن يكون التقييم السريري والإشعاعي كاملاً قبل إجراء الخزعة.
- على الرغم من أن الكتل الحميدة أكثر شيوعًا من الكتل الخبيثة، يجب دائمًا أخذ احتمال الإصابة بالسرطان في الاعتبار.
- الخزعة المغلقة كافية في معظم الحالات ويجب تفضيلها.
- إذا كان لابد من إجراء خزعة مفتوحة، فيجب أن يقوم بها الجراح الذي سيجري العملية الجراحية لاحقًا.
- يجب تنفيذ الطريقة المعروفة باسم الخزعة الاستئصالية (اعتبار الكتلة بالكامل كعينة للخزعة دون إزالة أي جزء وإجراء استئصال واسع) فقط في الحالات الخاصة.
- تشخيص وعلاج الساركوما عمل جماعي. يجب ترك هذا الأمر في أيدي مختصين مؤهلين.
إذا تم اتباع هذه المبادئ، يمكن تحقيق التشخيص الأكثر دقة مع الحد الأدنى من الضرر للمريض. تشمل هذه المبادئ ما يلي:
- الأورام الشحمية (الغدد الدهنية): إذا كان الورم متجانسًا وله نفس كثافة الأنسجة الدهنية في جميع تسلسلات التصوير، فلا داعي لإجراء خزعة.
- أورام العظام الحميدة ذات الأشعة النموذجية (مثل الأورام العظمية الغضروفية، الأورام الليفية غير المتعظمة، الأورام الغضروفية داخل العظم، وأكياس العظام البسيطة أحادية الغرفة). في الواقع، قد لا تتطلب هذه الآفات أي فحوصات إضافية إذا كانت صور الأشعة السينية عالية الجودة.
- بالإضافة إلى الأورام الشحمية (الكتل الرخوة ذات النتائج النموذجية في التصوير بالرنين المغناطيسي)، تشمل الحالات الأخرى الأورام الشفانية (شوانوما)، والأورام الوعائية الدموية، والتشوهات الشريانية الوريدية، والأورام المخاطية.
- الآفات النقيليّة لدى المرضى الذين تم تأكيد إصابتهم بسرطان خبيث أو ورم نقوي (ميالوما) من خلال الخزعة.
عادةً ما أقوم بإجراء خزعات الأنسجة الرخوة تحت تأثير التخدير الموضعي في العيادة. أُجري الخزعة باستخدام إبرة في غضون عشر دقائق تقريبًا، مع الحد الأدنى من الألم. يمكن للمريض العودة إلى العمل في نفس اليوم.
على الرغم من أنني أعمل مع أحد أكثر المتخصصين خبرة في الخزعات المغلقة بالإبرة، إلا أن التشخيص قد يكون نادرًا في بعض الحالات. في هذا الشأن، يوصي بعض الباحثين بالانتقال إلى الخزعة المفتوحة إذا لم يتم الوصول إلى التشخيص، بينما يفضل آخرون الاستمرار في الخزعة المغلقة حتى تحقيق التشخيص. شخصيًا، إذا قمت بإجراء خزعة مغلقة مرتين ولم أتمكن من الحصول على تشخيص، فأنا أفضل التحول إلى الخزعة المفتوحة.
أقوم بإجراء خزعات العظام في غرفة العمليات تحت التصوير الشعاعي، ويفضل أن تكون خزعة مغلقة بالإبرة. أُجري الخزعة تحت التخدير العام في إجراء يستغرق حوالي 15 دقيقة، لضمان عدم شعور المريض بأي ألم.
إذا كان هناك اشتباه في الإصابة بعدوى أثناء التصوير أو من خلال اختبارات الدم أو الفحص قبل الإجراء، فيجب إيقاف المضادات الحيوية، والانتظار لمدة لا تقل عن أسبوعين، وإجراء زراعات بكتيرية للكشف عن البكتيريا الهوائية واللاهوائية والعصيات الحمضية والفطريات.
في الماضي، كان من الشائع أخذ عينة مزرعة من كل خزعة وأخذ خزعة لكل مزرعة. ومع ذلك، بفضل طرق التصوير والمختبرات الحديثة، أصبح من الممكن تضييق احتمالية وجود عدوى لدى مرضى الخزعة. قد تؤدي المزارع غير الضرورية إلى تشخيص خاطئ للعدوى، مما قد يعرض المريض لعلاجات طويلة ومتعبة ومكلفة بالمضادات الحيوية.