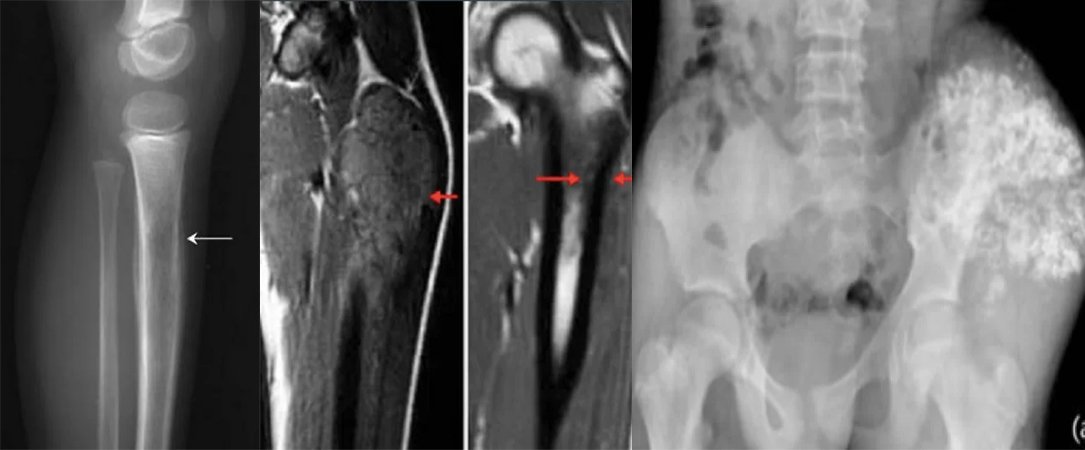
علاج ساركوما يوينغ
ساركوما يوينج هي ثاني أكثر الأورام الخبيثة الأولية شيوعًا في العظام، وتصيب المراهقين في العقد الثاني من العمر، وهي فئة شديدة الانتشار من الساركوما. وعلى الرغم من استخدام العلاج الإشعاعي أو الجراحة، فإن ما يقدر بنحو 85% إلى 90% من المرضى في الماضي ماتوا في غضون بضعة أشهر من النقائل. ولكن اليوم، وبفضل التقدم الكبير في علاج المرض بالعلاج الموضعي والعلاج الكيميائي المساعد متعدد العوامل، ارتفع معدل البقاء على قيد الحياة لمدة 5 سنوات من أقل من 20% إلى أكثر من 70%. ومع ذلك، لا يزال معدل الانتكاس مرتفعًا. يجب التعرف عليه ومعالجته على الفور لمنع ارتفاع معدلات الإصابة والوفيات. ساركوما يوينج هي ورم عدواني يحدث لدى المراهقين والشباب، ويمثل 10% إلى 15% من جميع ساركوما العظام.
وصفها جيمس إيوينج لأول مرة في عام 1921. تشمل عائلة ساركوما إيوينج ساركوما إيوينج العظمية "الكلاسيكية"، وساركوما إيوينج خارج الهيكل العظمي، والورم الخبيث صغير الخلايا في جدار الصدر (ورم أسكين) والأورام العصبية البدائية القائمة على الأنسجة الرخوة (PNET). يرتبط انتقال t(11؛ 22)(q24؛ q12) بنسبة 85٪ من الأورام ويؤدي إلى تكوين EWS-FLI-1، في حين أن t(21؛ 12)(22؛ 12) والانتقالات الأخرى الأقل شيوعًا تسبب EWS-FLI يحفز -1. يشكل اندماج ERG نسبة 10٪ إلى 15٪ المتبقية من الحالات. تشمل المناطق التشريحية الأكثر شيوعًا الحوض والهيكل العظمي المحوري وعظم الفخذ؛ ومع ذلك، يمكن أن يحدث في أي عظم أو نسيج رخو تقريبًا. عادة، يعاني المرضى من الألم والتورم في منطقة الإصابة. على الرغم من أن أغلب هذه الحالات موجودة موضعيًا، إلا أن أغلبها تعاني من مرض خبيث دون سريري. وفي النهاية، يعاني حوالي 25% من المرضى الذين يعانون من مرض موضعي أولي من الانتكاس.
لا يوجد علاج قياسي لسرطان الخلايا الليمفاوية المتكرر والمقاوم للعلاج. ولا يوجد ارتباط بين سرطان الخلايا الليمفاوية وعوامل الخطر البيئية أو التعرض للأدوية أو تاريخ الإشعاع أو التاريخ العائلي للإصابة بالسرطان. يتكون ساركوما يوينج من خلايا صغيرة مستديرة ذات نسبة نووية-سيتوبلازمية متزايدة، تمثل عائلة أورام الخلايا الزرقاء الصغيرة المستديرة التي تصيب الأطفال (على سبيل المثال، ورم الشبكية، وورم الخلايا العصبية، ورم العضلات المخططة، وورم الخلايا الكلوية). تحتوي خلايا يوينج على سيتوبلازم حمضي قليل يحتوي على جليكوجين وفير، وعادة ما يتم اكتشاف ذلك عن طريق تلطيخ شيف الدوري الحمضي. وقد تم إثبات ارتفاع التعبير عن CD99 في أكثر من 80% من الحالات. من المرجح أن يلعب هذا المؤشر المناعي الكيميائي عالي الحساسية دورًا رئيسيًا في تسهيل الهجرة المستمرة للكريات البيضاء إلى البطانة؛ ومع ذلك، ليس له خصوصية لأنه يمكن اكتشافه أيضًا في الساركوما والأورام اللمفاوية الأخرى. بالإضافة إلى منتج جين MIC2 CD99، تعبر خلايا يوينغ بشكل متكرر عن CD45، والسينابتوفيزين، والكروموجرانين، والفيمينتين، والفيمينتين، والكيراتين، والديسمين، والإينولاز الخاص بالخلايا العصبية (NSE)، وS-100. ومع ذلك، فإن لوحة المناعة النسيجية هذه محدودة بسبب الافتقار إلى التحديد. هناك حاجة إلى دراسات وراثية جزيئية باستخدام التهجين الموضعي الفلوري (FISH) و/أو تفاعل البوليميراز المتسلسل العكسي (RT-PCR) للتوصل إلى تمييز نهائي.
نتائج ساركوما يوينج: عادة ما يعاني مرضى ساركوما يوينج من أعراض موضعية مثل الألم أو التصلب أو التورم لعدة أسابيع أو أشهر. يعاني أكثر من 50% من مرضى ساركوما يوينج من آلام متقطعة تزداد سوءًا في الليل. يمكن أن يحدث ساركوما يوينج في مجموعة متنوعة من المواقع مع مظاهر مختلفة. يوجد عادة في عظام الجسم الطويلة. قد تحدث آفات العظام أو الآفات النقيلية في العظام الطويلة على شكل كسور مرضية. قد يظهر موقع ساركوما يوينج في الحوض على شكل آلام في الظهر. غالبًا ما يشير وجود أعراض جهازية مثل الحمى وفقدان الوزن إلى مرض نقيلي. يعاني حوالي 20% من المرضى من مرض نقيلي في وقت التشخيص، وأكثر من 20% من هذه الحالات تعاني من إصابة الرئة أو الجنبة.
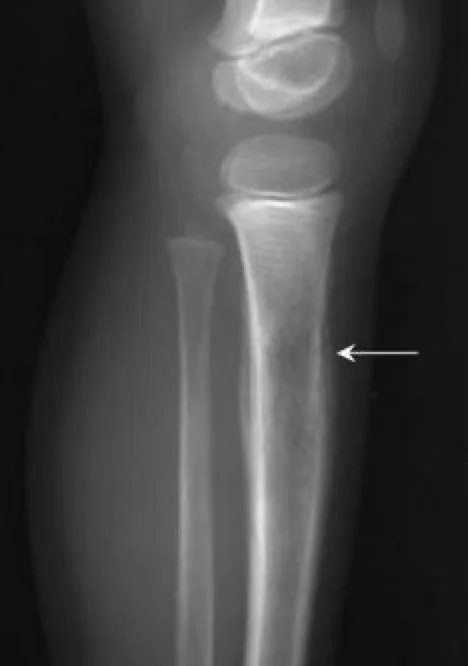
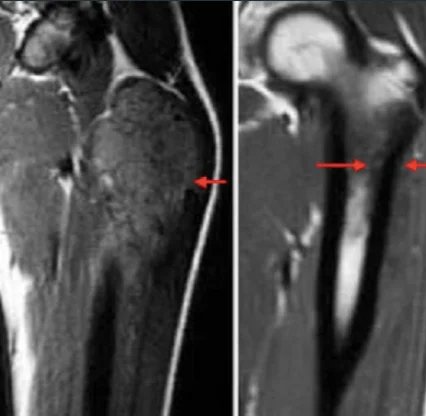
يعد الفحص البدني الشامل أمرًا مهمًا. في حالة نقائل الرئة والجنبة، قد يعاني المريض من أصوات تنفس غير متماثلة أو أعراض جنبية أو خرخرة. في المرضى الذين يعانون من نقائل نخاع العظم، قد يحدث بقع حمراء أو أرجوانية بسبب قلة الصفيحات. الفحص العصبي مهم أيضًا في المرضى الذين يعانون من إصابة الجهاز العصبي المركزي. تشمل الفحوصات الأولية الأشعة السينية للمنطقة المصابة؛ قد يظهر مظهر "قشر البصل" لتفاعل السمحاق على الأشعة السينية. يجب تقييم الموقع الأساسي والمناطق النقيلية المحتملة باختبارات التصوير. قد تظهر الأشعة السينية البسيطة للمنطقة المصابة آفات "أكلتها العثة" تدمر العظام، أو "مثلث كودمان"، أو تفاعل سمحاقي متعدد الطبقات "يشبه قشرة البصل". وفقًا لإرشادات الشبكة الوطنية الشاملة للسرطان (NCCN) المحدثة لعام 2017، يتم تصوير المناطق الأولية باستخدام التصوير بالرنين المغناطيسي، وإذا لزم الأمر، فإن التصوير المقطعي المحوسب والتصوير بالرنين المغناطيسي مع إعطاء مادة التباين له أهمية أساسية. تشمل طرق التصوير الأخرى التصوير المقطعي المحوسب للصدر، والتصوير المقطعي بالإصدار البوزيتروني (PET)/CT، والتصوير بالرنين المغناطيسي للعمود الفقري/الحوض. يجب إحالة المريض الذي تظهر عليه الأعراض إلى جراح أورام العظام إذا كانت هناك حاجة إلى خزعة. ويفضل إجراء التشخيص عن طريق خزعة بالإبرة أو خزعة مفتوحة. يجب تضمين التحليل الخلوي الجزيئي لعينات الخزعة في الفحص التشخيصي لتقييم انتقال T(11;22). يمكن النظر في شفط نخاع العظم وخزعة نخاع العظم. وفقًا لإرشادات NCCN، يجب أن يشمل التقييم الأولي تحليل لاكتات ديهيدروجينيز المصل (LDH) لأنه ذو أهمية تشخيصية. يجب أيضًا تقديم المشورة بشأن الخصوبة للمرضى (تجميد بويضات الحيوانات المنوية) قبل بدء العلاج.
العلاج الكيميائي والعلاج الإشعاعي لساركوما يوينج: تاريخيًا، قارنت دراسات ساركوما يوينج بين المجموعات (IESS-I وIESS-II) بين العلاج الإشعاعي والفينكريستين والداكتينوميسين والسيكلوفوسفاميد (RT+VACA) والعلاج الإشعاعي للفينكريستين والداكتينوميسين والسيكلوفوسفاميد (VAC). وأظهرت نتائج أفضل مع السيكلوفوسفاميد والدوكسوروبيسين. ونظرًا لقيود جرعة الدوكسوروبيسين في أنظمة علاج الداكتينوميسين، لم تظهر الدراسات اللاحقة تأثيرًا كبيرًا على النتائج السريرية عند استبعاد الداكتينوميسين. وقد قامت العديد من الدراسات بتقييم إضافة إيفوسفاميد وإيتوبوسيد إلى العلاج الكيميائي القياسي. وأظهرت دراسة مجموعة أورام الأطفال ومجموعة سرطان الأطفال INT0091 أن مجموعة VACD-IE كان لديها معدلات بقاء أفضل بشكل ملحوظ من مجموعة VACD.
بالإضافة إلى ذلك، كان معدل حدوث الفشل الموضعي أقل في مجموعة VACD-IE. في دراسة EICESS-92 (دراسة ساركوما يوينج التعاونية الأوروبية بين المجموعات)، تمت مقارنة VACA (فينكريستين، داكتينوميسين، سيكلوفوسفاميد ودوكسوروبيسين) وVAIA (فينكريستين، داكتينوميسين، إيفوسفاميد ودوكسوروبيسين) في المرضى المعرضين لخطر قياسي (SR) ووجد أن تأثير سيكلوفوسفاميد مشابه لإيفوسفاميد؛ ومع ذلك، ارتبط سيكلوفوسفاميد بزيادة السمية. كانت معدلات البقاء على قيد الحياة الخالية من الأحداث لمدة 3 سنوات (EFS) 73٪ و74٪ لـ VACA وVAIA، على التوالي. وقد قامت دراسة Euro-EWING99-R1 (دراسة التكافؤ القائمة على بروتوكول EICESS-92) بتقييم ما إذا كان السيكلوفوسفاميد يمكن أن يحل محل الإيفوسفاميد في العلاج التوطيدي بما في ذلك فينكريستين وداكتينوميسين في المرضى المعرضين لخطر قياسي وقارنت VAC (فينكريستين وداكتينوميسين وسيكلوفوسفاميد) بـVAI (فينكريستين وداكتينوميسين وسيكلوفوسفاميد). اقترحت دراسة VAC (إيفوسفاميد) أنها ليست أقل شأناً إحصائيًا؛ ومع ذلك، ارتبطت VAI ببقاء خالٍ من الأحداث لمدة 3 سنوات أعلى قليلاً. في دراسة المرحلة الثالثة (AEWS0031) من مجموعة أورام الأطفال (COG)، تلقى المرضى VDC بالتناوب مع IE كل ثلاثة أسابيع. أظهرت الدراسة أن فترات الأسبوعين كانت أكثر فعالية من فترات الأسابيع الثلاثة دون زيادة السمية.
أدت هذه النتائج إلى أن يصبح علاج VDC/IE هو المعيار للرعاية في الولايات المتحدة. يبدأ العلاج الكيميائي قبل العلاج الموضعي ويستمر بعد الجراحة إذا لم تظهر أي علامات على التقدم. الاستئصال الجراحي والعلاج الإشعاعي هما نهجان علاجيان موضعيان للتحكم. حتى الآن، لا توجد دراسات تقارن فعالية هذين النهجين. لم تجد دراسة INT-0091 أي اختلافات كبيرة في الفشل الموضعي أو البقاء على قيد الحياة بدون أحداث بين الجراحة وحدها والعلاج الإشعاعي وحده. ومع ذلك، وجد أن الجراحة بالإضافة إلى العلاج الإشعاعي مرتبطان بانخفاض معدل الفشل الموضعي. وعلى الرغم من ذلك، نعتقد أن تكرار المرض أمر لا مفر منه في الحالات التي يتم فيها إعطاء العلاج الإشعاعي فقط دون علاج جراحي. أظهرت البيانات من 1058 مريضًا من دراسات CESS 81 وCESS 86 وEICES-92 أن الجراحة + العلاج الإشعاعي والجراحة وحدها كان معدل الفشل الموضعي أقل بكثير من العلاج الإشعاعي وحده. كان معدل الفشل الموضعي مماثلاً في مجموعة العلاج الإشعاعي قبل الجراحة والمجموعة الجراحية مع أو بدون العلاج الإشعاعي بعد الجراحة. وبناءً على البيانات التي تم الحصول عليها من المرضى المسجلين في الدراسات INT-0091 أو INT-0154 أو AEWS0031، فقد تبين أن الجراحة + العلاج الإشعاعي كان مرتبطًا بانخفاض خطر الفشل المحلي مقارنةً بالعلاج الإشعاعي وحده.
2. ساركوما الغضروف
علاج ساركوما الغضروف: أعراض ساركوما الغضروف:
ما هو ساركوما الغضروف؟
الساركوما الغضروفية هي نوع من سرطان العظام يتطور من خلايا الغضروف. الغضروف هو نسيج ضام متخصص يوجد لدى البالغين وهو النسيج الذي تتطور منه معظم العظام. يلعب الغضروف دورًا مهمًا في عملية النمو. هناك العديد من أنواع الغضاريف المختلفة في الجسم. يؤثر الساركوما الغضروفية في المقام الأول على خلايا الغضروف في عظم الفخذ أو الذراع أو الحوض أو الركبة. قد تتأثر مناطق أخرى (مثل الأضلاع) أيضًا، وإن كان ذلك بشكل أقل تكرارًا. الساركوما الغضروفية هي ثاني أكثر أنواع سرطان العظام الأولي شيوعًا. سرطان العظام الأولي هو السرطان الذي يبدأ في العظام. نادرًا ما يصيب هذا النوع من السرطان الأفراد الذين تقل أعمارهم عن 20 عامًا. يستمر الخطر في الارتفاع حتى سن 75 عامًا. معدل الإصابة متساوٍ بين الرجال والنساء.
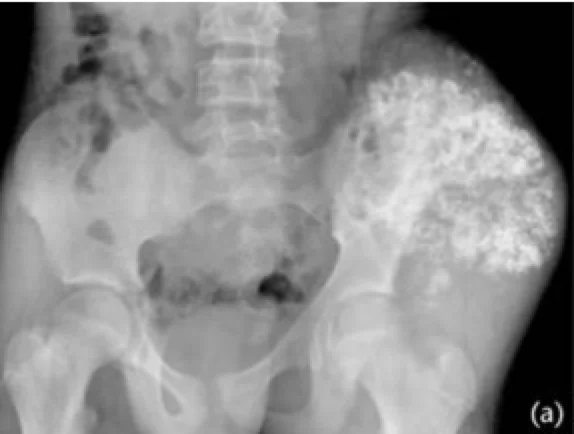
ما هي أسباب الإصابة بالساركوما الغضروفية؟
السبب الدقيق للإصابة بالساركوما الغضروفية غير معروف. قد يكون هناك مكون وراثي أو كروموسومي يجعل بعض الأفراد أكثر عرضة للإصابة بهذه الأورام الخبيثة. لوحظت الساركوما الغضروفية كنتيجة متأخرة للعلاج الإشعاعي لأنواع أخرى من السرطان.
ما هي عوامل الخطر للإصابة بالساركوما الغضروفية؟
في أغلب الأحيان، تنشأ الساركوما الغضروفية من خلايا الغضروف الطبيعية. وقد تنشأ أيضًا من ورم حميد (غير سرطاني) سابق في العظام أو الغضروف. فيما يلي قائمة ببعض الحالات الحميدة التي قد تكون موجودة عند حدوث الساركوما الغضروفية:
- الورم الغضروفي. نوع من أورام العظام الحميدة التي تبدأ في الغضروف وتؤثر عادة على اليدين (يمكن أن تؤثر أيضًا على مناطق أخرى).
- النتوءات العظمية الغضروفية المتعددة. وجود أورام عظمية غضروفية متعددة.
- مرض أولييه. مجموعة من الأورام الغضروفية (أورام الغضروف الحميدة التي تؤثر عادة على اليدين).
- متلازمة مافوتشي. مزيج من الأورام الغضروفية المتعددة (أورام الغضروف الحميدة التي تؤثر عادة على اليدين) والأورام الوعائية (أورام حميدة تتكون من أوعية دموية).
ما هي أعراض الساركوما الغضروفية؟
قد تختلف أعراض الساركوما الغضروفية حسب مكان الورم. وفيما يلي الأعراض الأكثر شيوعًا للساركوما الغضروفية. ومع ذلك، قد تحدث الأعراض بشكل مختلف في كل فرد. وقد تشمل الأعراض:
- كتلة كبيرة في العظم المصاب
- الشعور بالضغط حول الكتلة
- ألم يزداد تدريجيًا بمرور الوقت. وعادة ما يزداد سوءًا في الليل ويمكن تخفيفه بتناول أدوية مضادة للالتهابات مثل الإيبوبروفين. وعادة لا يخفف من الألم بالراحة.
- تورم موضعي
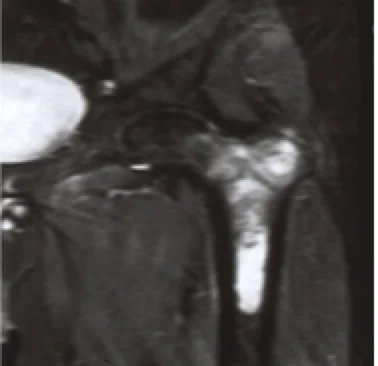
كيف يتم تشخيص ساركوما الغضروف؟
بالإضافة إلى التاريخ الطبي الكامل والفحص البدني، قد تشمل إجراءات تشخيص ساركوما الغضروف ما يلي:
- الأشعة السينية. وهو اختبار تشخيصي يستخدم أشعة غير مرئية من الطاقة الكهرومغناطيسية لتحويل صور الأنسجة الداخلية والعظام والأعضاء إلى فيلم.
- فحص التصوير المقطعي المحوسب (يُطلق عليه أيضًا CT أو CAT scan). وهو اختبار تصوير يستخدم الأشعة السينية والكمبيوتر لإنشاء صور مفصلة للجسم. يُظهر فحص التصوير المقطعي المحوسب تفاصيل العظام والعضلات والدهون والأعضاء.
- التصوير بالرنين المغناطيسي (MRI). إجراء تشخيصي يستخدم مزيجًا من المغناطيسات الكبيرة والترددات الراديوية وأجهزة الكمبيوتر لالتقاط صور مفصلة للأعضاء والهياكل في الجسم.
- فحص التصوير المقطعي بالإصدار البوزيتروني (PET). اختبار تصوير يتم فيه حقن الجلوكوز (السكر) المشع في مجرى الدم. يمكن اكتشاف الأنسجة التي تستخدم الجلوكوز أكثر من الأنسجة الطبيعية (مثل الأورام) بواسطة جهاز مسح.
- الخزعة. إجراء يتم فيه إزالة عينات الأنسجة من الجسم (إما عن طريق الحقن أو أثناء الجراحة) للفحص تحت المجهر. يتم ذلك لتحديد ما إذا كان السرطان أو أي خلايا غير طبيعية أخرى موجودة.
علاج الساركوما الغضروفية:
سيتم تحديد العلاج المحدد للساركوما الغضروفية من قبل مقدم الرعاية الصحية الخاص بك بناءً على:
- عمرك وصحتك العامة وتاريخك الطبي
- نوع ومرحلة (انتشار) وموقع السرطان
- تحملك لبعض الأدوية والإجراءات والعلاجات
- التوقعات بشأن مسار المرض
- رأيك أو تفضيلاتك
الهدف من علاج ساركوما الغضروف هو إزالة الكتلة وتقليل احتمالية عودتها. قد يشمل العلاج:
- الجراحة. إزالة الورم. إذا كان الورم في الذراع أو الساق، سيحاول الجراح إنقاذ الطرف. في بعض الحالات، قد تكون هناك حاجة إلى البتر.
- العلاج الطبيعي. يساعد هذا العلاج على استعادة القوة واستخدام المنطقة المصابة بعد الجراحة.
- العلاج الإشعاعي. يمكن إعطاء الإشعاع بجرعات عالية.
- العلاج الكيميائي. على الرغم من أنه ليس علاجًا أساسيًا، فقد يكون ضروريًا إذا انتشر السرطان إلى أجزاء أخرى من الجسم.
3. ساركوما العظام
ما هو ساركوما العظام؟
ساركوما العظام (OS) أو ساركوما العظام (OGS) (أو سرطان العظام باختصار) هو ورم سرطاني في العظام. على وجه التحديد، هو ورم خبيث عدواني ينشأ من خلايا بدائية متحولة من أصل ميزانشيمي، ويظهر تمايزًا عظميًا وينتج أورامًا عظمية خبيثة. ساركوما العظام هو الشكل النسيجي الأكثر شيوعًا لساركوما العظام الأولية. وهو أكثر شيوعًا بين المراهقين والشباب.
أعراض ساركوما العظام:
يشكو العديد من المرضى أولاً من آلام طويلة الأمد تزداد سوءًا في الليل، ويمكن أن تكون متقطعة ومتغيرة الشدة. غالبًا ما يشكو الشباب الذين يشاركون بنشاط في الرياضة من الألم في الجزء السفلي من عظم الفخذ أو أسفل الركبة مباشرة. إذا كان الورم كبيرًا، فقد يظهر على شكل تورم موضعي بارز. في بعض الأحيان قد يكون الكسر المفاجئ هو أول أعراض الورم لأن العظم المصاب ليس بنفس قوة العظم الطبيعي ويمكن أن ينكسر بشكل غير طبيعي عند التعرض لصدمة بسيطة. في الأورام العميقة التي لا تكون قريبة جدًا من الجلد، مثل تلك التي تنشأ من الحوض، قد لا يكون التورم الموضعي واضحًا.
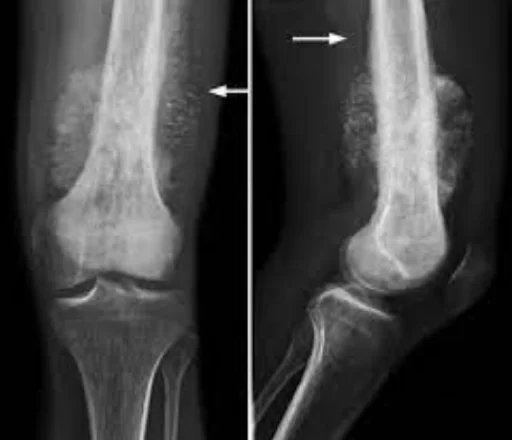
أسباب ساركوما العظام:
ترتبط الحالات العائلية التي يؤدي فيها حذف الكروموسوم 13q14 إلى تعطيل جين الورم الشبكي بارتفاع خطر الإصابة بساركوما العظام. كما تزيد حالات خلل تنسج العظام، بما في ذلك مرض باجيت العظمي، وخلل التنسج الليفي، وتضخم الغضاريف، والنتوءات العظمية المتعددة الوراثية، من خطر الإصابة بساركوما العظام.
متلازمة لي-فراوميني (طفرة في الجين الجرثومي TP53) هي عامل مؤهب لتطور ساركوما العظام. وترتبط متلازمة روثموند-تومسون (أي الارتباط المتنحي الجسدي بين عيوب العظام الخلقية، وخلل تنسج الشعر والجلد، وقصور الغدد التناسلية، وإعتام عدسة العين) بزيادة خطر الإصابة بهذا المرض. وتزيد الجرعات العالية من Sr-90 من خطر الإصابة بسرطان العظام وسرطان الدم لدى الحيوانات، ومن المتوقع أن تفعل الشيء نفسه لدى البشر.
هل يسبب الفلورايد سرطان العظام؟
لا توجد علاقة واضحة بين إضافة الفلورايد إلى المياه والسرطان أو الوفيات المرتبطة بالسرطان، سواء بالنسبة للسرطان بشكل عام أو بالنسبة لسرطان العظام وسرطان العظام بشكل خاص. وقد خلص عدد من الدراسات إلى أن تركيز الفلورايد في المياه لا يرتبط بسرطان العظام. وتنبع المعتقدات المتعلقة بالعلاقة بين التعرض للفلورايد وسرطان العظام من دراسة أجريت عام 1990 من قبل برنامج علم السموم الوطني الأمريكي والتي أظهرت أدلة غير قاطعة على وجود علاقة بين الفلورايد وسرطان العظام في ذكور الفئران. ومع ذلك، لا يوجد حتى الآن دليل قاطع على أن الفلورايد لديه ميل للتسبب في السرطان في الفئران. يتم ممارسة إضافة الفلورايد إلى المياه في جميع أنحاء العالم لتحسين صحة الأسنان للمواطنين. كما يعتبر إنجازًا صحيًا كبيرًا. يتم تنظيم مستويات تركيز الفلورايد في إمدادات المياه، مثل وكالة حماية البيئة الأمريكية التي تنظم مستويات الفلورايد بحيث لا تزيد عن 4 مليجرام لكل لتر. في الواقع، يوجد الفلورايد الطبيعي بالفعل في إمدادات المياه، لكن العديد من المجتمعات اختارت إضافة المزيد من الفلورايد إلى الحد الذي يمكنه من الحد من تسوس الأسنان. يُعرف الفلورايد أيضًا بقدرته على التسبب في تكوين عظام جديدة. ومع ذلك، تُظهر الأبحاث الإضافية أن المياه المفلورة لا تشكل خطرًا للإصابة بسرطان العظام لدى البشر. تضمنت معظم الدراسات إحصاء عدد مرضى سرطان العظام في مناطق محددة ذات تركيزات مختلفة من الفلورايد في مياه الشرب. يُظهر التحليل الإحصائي للبيانات أنه لا يوجد فرق كبير في حدوث حالات سرطان العظام في المناطق المختلفة المفلورة. تضمنت دراسة مهمة أخرى جمع عينات العظام من مرضى سرطان العظام لقياس تركيز الفلورايد ومقارنتها بعينات العظام من أورام العظام الخبيثة التي تم تشخيصها حديثًا. الاستنتاج هو أن متوسط تركيزات الفلورايد في عينات العظام من مرضى سرطان العظام وضوابط الورم لم تكن مختلفة بشكل كبير. وقد ثبت أن ليس فقط تركيز الفلورايد في العظام، ولكن أيضًا التعرض للفلورايد لدى مرضى ساركوما العظام لا يختلف بشكل كبير عن الأشخاص الأصحاء.يميل ساركوما العظام إلى الحدوث في مناطق نمو العظام؛ وربما يرجع هذا إلى أن التكاثر يجعل الخلايا العظمية في هذه المنطقة عرضة لاكتساب طفرات قد تؤدي إلى تحول الخلايا (جين RB وجين p53). وقد يقع الورم في نهاية العظم الطويل (عادة في الكردوس). وغالبًا ما يؤثر على الطرف القريب من قصبة الساق أو عظم العضد أو الطرف البعيد من عظم الفخذ. ويميل ساركوما العظام إلى التأثير على المناطق المحيطة بالركبة في 60% من الحالات، وحول الورك في 15%، والكتف في 10%، والفك في 8%. والورم صلب وصلب وغير منتظم لأن أشواك الورم في العظم المتكلس تشع بزوايا قائمة (مظهر "شجرة التنوب" أو "أكلتها العثة" أو "غروب الشمس" في فحص الأشعة السينية). وتشكل هذه الزوايا القائمة ما يُعرف بمثلث كودمان؛ هذه سمة مميزة ولكنها ليست سمة تشخيصية لسرطان العظام.
تشخيص ساركوما العظام:
تعتبر الأشعة السينية هي الطريقة التصويرية الأولية المفضلة لتشخيص ساركوما العظام. ومن بين سمات ساركوما العظام في الأشعة السينية منظر غروب الشمس ومثلث كودمان (ارتفاع قشرة العظام للورم مما يسبب تكوين عظم جديد). يعد التصوير المقطعي المحوسب مفيدًا في تحديد تشريح العظام وسلامة قشرة العظام واكتشاف الكسر المرضي وتقييم التعظم (وضع مواد عظمية جديدة) وتكلس الغضاريف. من ناحية أخرى، يمكن تصور الأنسجة الرخوة والتجويف النخاعي بشكل أفضل باستخدام التصوير بالرنين المغناطيسي.
يجب أن يقوم أخصائي أورام العظام المؤهل بإجراء خزعة من ساركوما العظام المشتبه بها. تنص جمعية السرطان الأمريكية على ما يلي: "ربما لا يكون من المهم في أي حالة أخرى من حالات السرطان إجراء هذا الإجراء بشكل صحيح. "يمكن أن تجعل الخزعة التي يتم إجراؤها بشكل غير صحيح من الصعب إنقاذ الطرف المصاب من البتر". يمكن أن ينتشر أيضًا إلى الرئتين ويظهر بشكل أساسي على شكل عقيدات مستديرة مفردة أو متعددة في المناطق السفلية على الأشعة السينية للصدر.
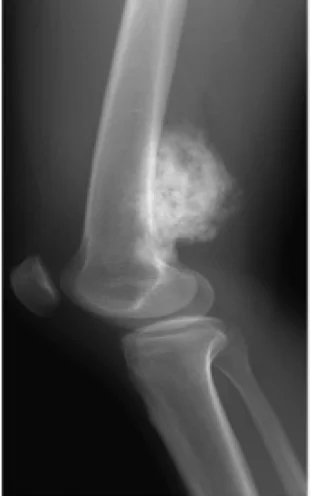
أنواع الساركوما العظمية:
- التقليدية: خلايا عظمية عظمية، وخلايا غضروفية، وخلايا ليفية
- توسع الشعيرات
- خلية صغيرة
- مركزي منخفض الدرجة
- السمحاق
- مظلي
- ثانوي
- سطح عالي الجودة
- خارج الهيكل العظمي
علاج ساركوما العظام:
يعد الاستئصال الجراحي الكامل للسرطان في حالة ساركوما العظام هو طريقة العلاج المفضلة. ورغم أن معظم المرضى يمكنهم الخضوع لجراحة إنقاذ الأطراف، إلا أن المضاعفات (خاصة العدوى، وارتخاء الأطراف الصناعية وعدم التئامها، أو تكرار الورم المحلي) قد تؤدي إلى الحاجة إلى إجراء جراحة أخرى أو البتر.
يُعالج مرضى ساركوما العظام على أفضل نحو بواسطة طبيب أورام العظام المتخصص في علاج الساركوما. والعلاج القياسي الحالي هو العلاج الكيميائي المساعد (العلاج الكيميائي الذي يُعطى قبل الجراحة) يليه الاستئصال الجراحي. وتعطي نسبة نخر الخلايا السرطانية (موت الخلايا) التي تظهر في الورم بعد الجراحة فكرة عن التشخيص كما تسمح لطبيب الأورام بمعرفة ما إذا كان نظام العلاج الكيميائي يحتاج إلى تغيير بعد الجراحة.
العلاج القياسي هو جراحة العظام لإنقاذ الأطراف (أو البتر في بعض الحالات) عندما يكون ذلك ممكنًا وإنقاذ الليوكوفورين بجرعات عالية من الميثوتركسيت، ومزيج من السيسبلاتين داخل الشرايين، والأدرياميسين، والميسنا مع إيفوسفاميد، وBCD (بليومايسين، وسيكلوفوسفاميد، وداكتينوميسين) وإيتوبوسيد وميراميل تريبتيد. البروتوكول المستخدم هو نظام علاجي عدواني داخل الشرايين يخصص العلاج بناءً على الاستجابة الشريانية. في بعض الدراسات، يتراوح معدل البقاء على قيد الحياة لمدة ثلاث سنوات بدون أحداث من 50% إلى 75%، بينما يتراوح معدل البقاء على قيد الحياة لمدة خمس سنوات من 60% إلى 85%. بشكل عام، سيظل 65-70% من المرضى الذين عولجوا قبل خمس سنوات على قيد الحياة اليوم. هذه معدلات البقاء على قيد الحياة هي متوسطات عامة وتختلف بشكل كبير اعتمادًا على معدل النخر الفردي.
مسار مرض ساركوما العظام:
الدرجة الأولى من ساركوما العظام نادرة وتشمل ساركوما العظام في الجزء الخلفي من العظم وساركوما العظام المركزية منخفضة الدرجة. ولديها تشخيص ممتاز (>90٪) مع استئصال واسع النطاق. يعتمد التشخيص العام على موقع الورم (القصبة القريبة، عظم الفخذ، الحوض، إلخ)، وحجم كتلة الورم، ودرجة النخر الناتجة عن العلاج الكيميائي المساعد. كما أن العوامل المرضية الأخرى، مثل درجة بروتين P-glycoprotein، وما إذا كان الورم إيجابيًا لـ cxcr4 أو إيجابيًا لـ Her2، مهمة أيضًا لأنها مرتبطة بنقائل بعيدة إلى الرئة. تنخفض معدلات الوفيات بسبب ساركوما العظام بنحو 1.3٪ سنويًا. تحسنت احتمالات البقاء على قيد الحياة على المدى الطويل لساركوما العظام بشكل ملحوظ في أواخر القرن العشرين، حيث وصلت إلى حوالي 68٪ في عام 2009.






